Introduction
플라보노이드(flavonoids)는 과일, 채소, 곡류 및 허브류에 널리 포함된 폴리페놀(polyphenol) 성분으로 건강에 유익한 효과들이 가장 많이 보고되고 있는 식물유래영양성분(phytonutrient)이다. 현재 5,000가지 이상의 flavonoids가 확인되어 있으며 일상적으로 섭취하는 식품에는 수백 종의 플라보노이드가 존재한다고 알려져 있다(Holden et al., 2005). Flavonoids는 두 개의 방향족인 A와 B가 산화형 heterocyclic C링에 3-탄소 체인으로 연결되어 있는 기본구조를 가지고 있고, heterocyclic C링의 산화상태나 작용기에 따라 안토시아니딘(anthocyanidins), 플라바놀(flavan-3-ols), 플라바논(flavanones), 플라본(flavones), 플라보놀(flavonols)로 분류된다(Liu, 2004). 이소플라본(isoflavones)은 B링이 3번 대신 2번에 붙은 것이 특징이며 프로안토시아니딘(proantocyanidins)은 플라바놀(flavan-3-ols)의 중합체이며, flavonoid의 기본적인 화학구조는 Figure 1 (Song et al., 2012)과 같다.
그중 biflavonoid는 플라보노이드 2분자가 결합한 이합체로 아멘토플라본(amentoflavone), 아가디스플라본(agathisflavone), 쿠프레스플라본(cupressflavone), 히노키플라본(hinokiflavone)등이 있으며, flavonoid 2분자는 같은 종류인 경우도 있고, 다른 경우도 있으며, 주로 겉씨식물(gymnosperm)에 많다(Okigawa et al., 1971). Amentoflavone의 기본적인 화학구조는 (Sakthivel & Guruvayoorappan, 2013; Figure 2)와 같다.
인체에는 유리기에 의한 손상으로부터 자신을 보호할 수 있는 항산화 방어 체계가 있다. H2O2 (hydrogen peroxide)는 ROS 종류 중 반응성이 크지 않지만, 특정 상태에서 반응성이 더욱 큰 1O2 (singlet oxygen)나 OH- (hydroxyl radical)로 전환될 수 있기 때문에 H2O2에 대한 소거도 중요한 인체 방어 시스템 중 하나이다. 또한 H2O2는 산화 스트레스의 원인을 제공하며 다수의 유전자 전사 인자의 발현, 칼슘과 철 같은 이온의 항상성을 변화시키고, 세포의 확산과 분화를 유발하는 능력을 가지고 있다(Barbouti et al., 2002). O2- (superoxide anion) radical은 산소를 소비하는 모든 생물종에 존재하는 항산화 효소인 SOD에 의해 제거되지 못하면 H2O2로 전환되며 이렇게 생성된 H2O2는 CAT에 의해 제거되지 않으면 세포 내에서 ROS로 인한 산화적 스트레스를 유발한다.
MMPs는 세포 외 기질 분해에 관여하는 금속성 분해 효소로서, 정상적인 발생과정, 혈관생성 및 상처재생 뿐만 아니라, 세포간질의 분해가 전제 조건인 암의 전이와 관절염, 골다공증, 치막염 등의 질병에 관여하는 것으로 알려져 있다(Liotta et al., 1980; Bonfil et al., 1989; Liotta & Stetler, 1990; Matrisian, 1990). 노화된 피부의 진피 내 콜라겐 양의 감소는 fibroblast의 콜라겐 합성이 감소되거나, MMPs와 같은 효소에 의한 콜라겐의 분해가 증가되었을 경우에 생긴다. 또한 자외선이나, ROS에 지속적으로 노출된 피부에서의 심한 콜라겐 감소가 주름 생성의 중요한 원인이 되기도 한다. 콜라겐은 포유동물 체내 단백질의 약 30% 이상을 차지하고 있으며 특히 근육, 연골, 뼈, 피부, 혈관벽, 치아 등에 주로 분포하고 있다. 콜라겐의 구조는 3-나선형 분자(triple-helical molecule)로써 2개 α1(Ⅰ)chain과 1개의 α2(Ⅰ)chain으로 이루어져 있으며 polypeptide 사슬은 대게 글리신(glycine), 프롤린(proline), 히드록시프롤린(hydroxyproline)의 아미노산 잔기 3개로 이루어져 있다. 현재까지 19 types의 collagen이 밝혀져 있으며, 각각의 type collagen들은 우리 몸을 구성하는데 다양하게 사용되고 있다(Glimcher, 1989; Bailly et al., 1990). 이처럼 콜라겐은 인간의 체내에서 항상 분해와 합성이 반복되는데 나이가 들어감에 따라 균형이 붕괴되고 합성보다는 분해가 더욱 많아지게 된다.
정상 체세포는 배양할 때에 제한된 수의 분열을 한 뒤에 비가역적인 증식억제 상태에 이르게 되며 이 상태를 세포노화(replicative senescence)라고 한다(Hayflick & Moorehead, 1961). 세포노화 현상은 in vivo에서 세포가 재생능력을 잃어버려 발생한다고 생각된다(Campisi, 2007). 정상 체세포가 제한된 수의 분열을 하는 반면, 암세포는 무한히 분열하기 때문에 세포노화는 개체를 암으로부터 보호하는 역할을 하는 것으로도 알려졌다(Braig et al., 2005; Collado et al., 2005; Michaloglou et al., 2005). 세포노화는 배양을 통해서 일어날 뿐만 아니라, DNA damage를 일으켜서도 유도할 수 있다. Apoptosis를 일으키는 것보다는 조금 약한 DNA damage를 주면 세포노화로 진행되며, 강한 DNA damage를 주었을 때에는 apoptosis로 진행하는 것으로 생각된다(Luschen et al., 2000).
따라서, 본 연구에서는 항산화 및 항노화와 관련된 실험을 통해 amentoflavone의 항노화 화장품 소재로서의 발전 가능성을 확인해보고자 한다.
Methods
1. Cell viabililty
세포 생존율은 WST-1 assay를 이용하였으며 측정은 세포 내 소기관인 미토콘드리아의 탈수소효소에 의해 생성되는 formazan의 흡광도를 측정하는 원리로 이루어진다. 96 well plate에 3×103 HDFs를 접종하여 24시간 배양하고, amentoflavone는 5, 10, 15, 20, 25 µM 농도로 처리하고 H2O2는 0.1, 0.2, 0.3, 0.4, 0.5 mM 처리한 후 24시간 동안 추가 배양하였다. 배양된 well에 EZ-Cytox cell viability assay kit reagent (ItsBio, Korea) 10 μL를 첨가하여 1시간 배양 후 microplate reader (Bio-Rad, USA)를 이용하여 490 nm에서 흡광도 측정하였으며, 3회 반복 수행하여 세포생존율 평균값과 표준편차를 도출하였다.
2. Antioxidant assay in vitro
1) DPPH radical scavenging activity assay
DPPH (1,1-diphenyl-2-picrylhydrazyl) radical 소거 활성 실험은(Blois, 1958)을 응용하여 다음과 같이 실행하였다. 96 well plate에 amentoflavone을 1, 2, 5, 10, 15 μM 농도로 하여 희석액를 100 μL씩 분주한 후 여기에 0.2 mM의 DPPH 50 μL을 넣은 후 30분간 방치한다. 동일한 방법으로 BHT(butylated hydroxy toluene)도 1, 2, 5, 10, 15 μM 농도로 처리한다. Microplate reader (Bio-Rad, USA)를 이용하여 514 nm에서 흡광도를 측정하였으며, 측정은 3회 반복 수행하여 흡광도의 평균값과 표준편차를 도출하였다.
2) ABTS radical scavenging activity assay
ABTS [2,2-azinobis-(3-ethylbenzo-thiazoline-6-sulfonate)] 라디칼을 이용한 항산화능은 potassium persulfate와의 반응에 의해 생성된 ABTS+ 유리 라디칼이 시료 중의 항산화 물질에 의해 제거되어 라디칼 특유의 청록색이 탈색되는 원리를 이용한 방법이다(Re et al., 1999; Roberta et al., 1999). 7.4 mM ABTS와 2.6 mM potassium persulfate를 최종농도로 혼합하여 실온의 암실에서 12시간 동안 방치하여 ABTS+를 형성시킨 후 732 ㎚에서 흡광도 값이 0.706 (±0.01)이 나오도록 한다. 96 well plate에 희석된 amentoflavone 1, 2, 5, 10, 15 μM 농도로 하여 100 μL씩 분주하고 여기에 ABTS+ 100 μL을 가하여 7분 동안 방치한다. 동일한 방법으로 BHT도 1, 2, 5, 10, 15 μM 농도로 처리한다. Microplate reader (Bio-Rad, USA)를 이용하여 732 nm에서 흡광도를 측정하였으며, 측정은 3회 반복 수행하여 흡광도의 평균값과 표준편차를 도출하였다.
3) Hydrogen peroxide scavenging activity assay
활성산소는 피부노화를 일으키는 대표적인 물질이기 때문에, in vitro 실험을 통해 H2O2 제거능을 확인하는 것으로 시험물질의 항산화능을 확인할 수 있다(Long et al., 1999). Amentoflavone을 각각 1, 2, 5, 10, 15 μM 농도로 하여 500 μL씩 분주하고 여기에 40 mM의 H2O2를 500 μL을 넣은 후 10분간 방치한다. 동일한 방법으로 LA (L-ascorbic acid)도 1, 2, 5, 10, 15 μM 농도로 처리한다. 96 well plate에 일정량 분주하여 microplate reader (Bio-Rad, USA)를 이용하여 230 nm에서 흡광도를 측정하였으며, 측정은 3회 반복 수행하여 흡광도의 평균값과 표준편차를 도출하였다.
4) DCF-DA cellular ROS detection assay
세포 내 활성산소종 농도 변화를 측정하기 위해 HDFs (2×105 cells/well)를 60 mm 배양접시에 접종하여 24시간 배양 후, amentoflavone을 5, 10, 15 μM 농도로 각각 처리하고 H2O2 처리 후 추가로 24시간을 배양하였다. 세포 내 활성산소종을 측정하기 위한 dye인 DCF-DA (dichlorofluorescein diacetate)를 10 μM 첨가하여 30분 배양 후 세포를 수확하여 PBS를 첨가하여 세포를 풀어준 다음 flow cytometer (BD Biosciences, USA)를 이용하여 ROS의 변화량을 측정하였다. Amentoflavone의 활성산소종 제거 효능을 검증하기 위해 ROS scavenger 역할을 하는 NAC (N-acetyl-L-cystein)도 동일한 방식으로 처리한 후 측정하였다.
3. Quantitative real-time PCR (qRT-PCR)
H2O2와 amentoflavone에 의해 HDFs 내에서 일어나는 COL1A1, MMP1, MMP3, IL-6, TNF-α, CAT, SOD1 유전자 변화를 정량하기 위하여 quantitative real-time PCR (qRT-PCR)을 수행하였다. Amentoflavone 및 H2O2가 처리된 HDFs의 RNA 추출을 위해 60 mm 세포배양 접시에 HDFs (2×105 cells/well)로 seeding하고, amentoflavone을 5, 10, 15 μM 농도로 처리하고 3시간 전처리 후, H2O2를 처리하여 24시간 배양하였다. 세포배양이 끝난 세포를 trizol reagent (Invitrogen, USA)를 이용하여 용해 후 0.2 mL chloroform (Biopure, Canada)를 첨가하여 상온에 방치한다. 12,000 rpm, 4℃ 조건으로 20분간 원심분리하여 단백질이 포함된 하등액과 mRNA가 포함된 상등액을 분리한다. 상등액은 0.5 mL isopropanol을 첨가하여 10분간 상온에 방치한 다음 12,000 rpm, 4℃ 조건으로 원심분리하여 RNA를 침전시키고 75% ethanol을 이용하여 세척 후 ethanol을 제거하고 상온에서 건조시킨다. 건조된 mRNA는 diethylpyrocarbonate (DEPC, Biopure)를 water로 녹여 실험에 사용하였으며, 추출된 RNA는 nanodrop (Nanodrop, USA)을 이용하여 260 nm, 280 nm의 ratio 1.8 이상의 순도의 RNA만을 실험에 사용하였다.
추출된 RNA를 이용하여 PCR tube에 1 μg RNA, 0.5 ng oligo dT18, DEPC water를 total 10 μL로 제조 후 70℃에서 10분간 처리하여 RNA 변성을 유도한 다음 M-MLV reverse transcriptase (Enzynomics, Korea)을 이용하여 37℃에서 1시간 반응시켜 cDNA를 합성하였다. cDNA를 주형으로 qRT-PCR을 이용하여 amentoflavone에 의해 세포 내에서 일어나는 전사적인 유전자 발현 변화를 정량적으로 확인하였다. qRT-PCR은 HOT FIREPol EvaGreen PCR Mix Plus (Solis BioDyne), 1 pmole forward primer, 1 pmole reverse primer, 10 ng cDNA를 혼합하여 반응액을 만들어 Linegene K (BioER, China)를 이용하여 반응을 진행하였다. 반응의 세부 과정은 94℃에서 3분간 denaturation 후, denaturation (94℃, 30초), annealing (58℃, 30초), polymeration (72℃, 30초)을 40 cycle 수행하여 PCR을 진행하였다. PCR의 유효성은 melting curve로 검증하였고, 각 유전자의 발현은 β-actin의 발현을 표준화하여 비교 분석하였다.
4. Senescence associated β-galactosidase assay
세포 노화(senescence)는 β-galactosidase를 염색하는 방법인 SA-β-gal (senescence associated β-galactosidase) assay를 이용하여 측정하였다(Dimri et al., 1995). SA-β-gal assay는 senescence detection kit (Biovision, USA)를 사용하였으며, HDFs (2×105 cells/well)로 60 mm 배양접시에 접종하여 24시간 동안 배양 후 amentoflavone을 5, 10, 15 μM 농도로 각각 처리하고 H2O2를 처리 후 24시간 배양하였다. 배양된 HDFs는 배지를 제거하고 1 mL PBS로 세척 후 fixing solution 0.5 mL 을 첨가하여 상온에서 15분간 방치하여 고정시킨다. 고정된 HDFs를 staining solution 혼합액(staining solution 470 μL, staining supplement 5 μL, 20 mg/mL X-gal in dimethylformamide 25 μL)를 0.5 mL씩 첨가하고 37℃에서 24시간 동안 배양하여 세포 염색을 한다. 염색된 세포는 PBS로 세척 후 광학현미경(Olympus, Japan)을 통하여 염색된 세포 수를 측정하여 세포의 비율을 분석한다.
Results and Discussion
1. Inhibition of cell damage by amentoflavone
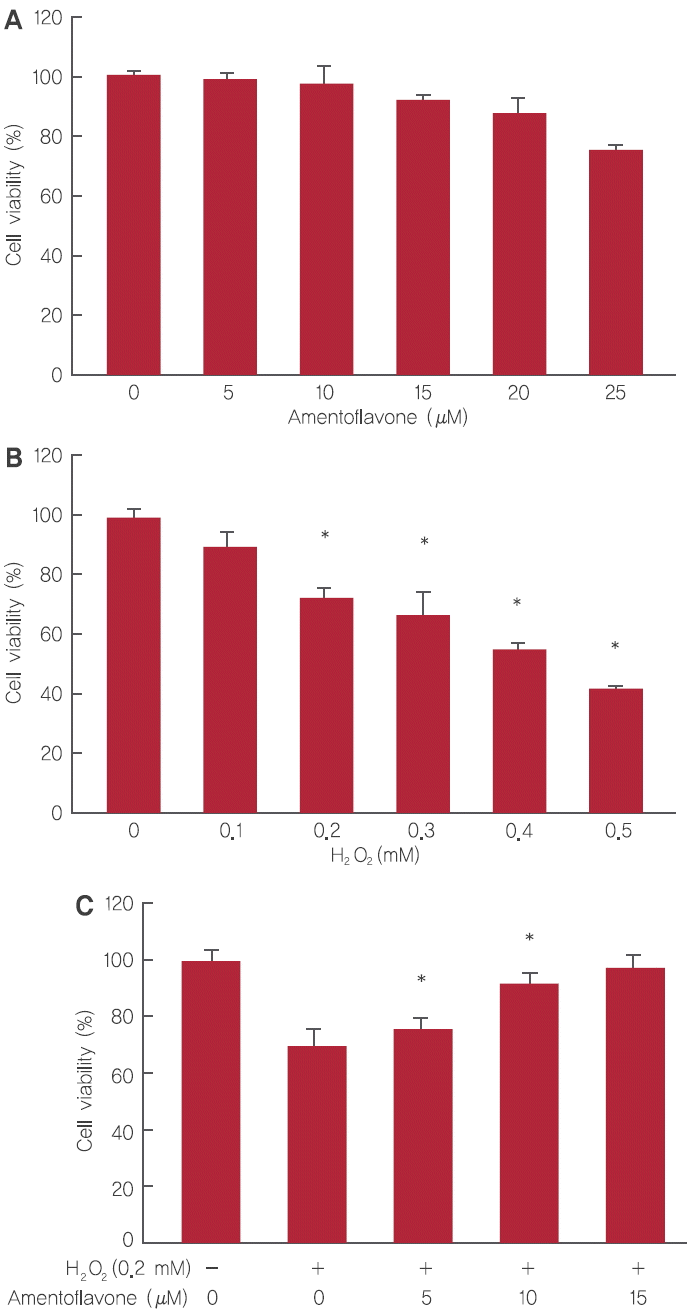
HDFs에 시험물질인 amentoflavone의 세포독성을 확인하기 위해 농도별로 amentoflavone을 처리한 결과, amentoflavone 5, 10, 15, 20, 25 µM 처리 시 99.2%, 97.9%, 92.2%, 87.9%, 77.6%의 세포 생존율을 가지는 것을 확인할 수 있었다. 본 연구에서는 세포 생존율 90% 이상을 기록하는 amentoflavone 5, 10, 15 μM을 이 후 실험농도로 적용하였다(Figure 3A).
HDFs에 H2O2를 사용하여 산화적 스트레스를 유도하고 세포 생존 회복율의 변화를 확인하였다. HDFs에 H2O2를 0.1, 0.2, 0.3, 0.4, 0.5 mM 농도로 처리할 경우 세포 생존율은 각각 89.6%, 72%, 66.6%, 55.3%, 42.7%을 나타냈으며, H2O2 적용 농도는 세포 생존율이 70% 이상인 0.2 mM를 사용하기로 결정하였다(Figure 3B).
H2O2의 HDFs 세포 손상에 대한 amentoflavone의 세포 보호 효과를 확인하기 위해 HDFs에 amentoflavone을 5, 10, 15 µM의 농도로 3시간 전처리 후 H2O2를 0.2 mM을 처리하여 세포 생존율의 변화를 확인하였다. Amentoflavone은 5, 10, 15 μM 처리 시 각각 75.5%, 92.6%, 97.1%로 농도 의존적으로 세포 생존율이 증가함을 확인하였다(Figure 3C).
2. Antioxidant effects of amentoflavone
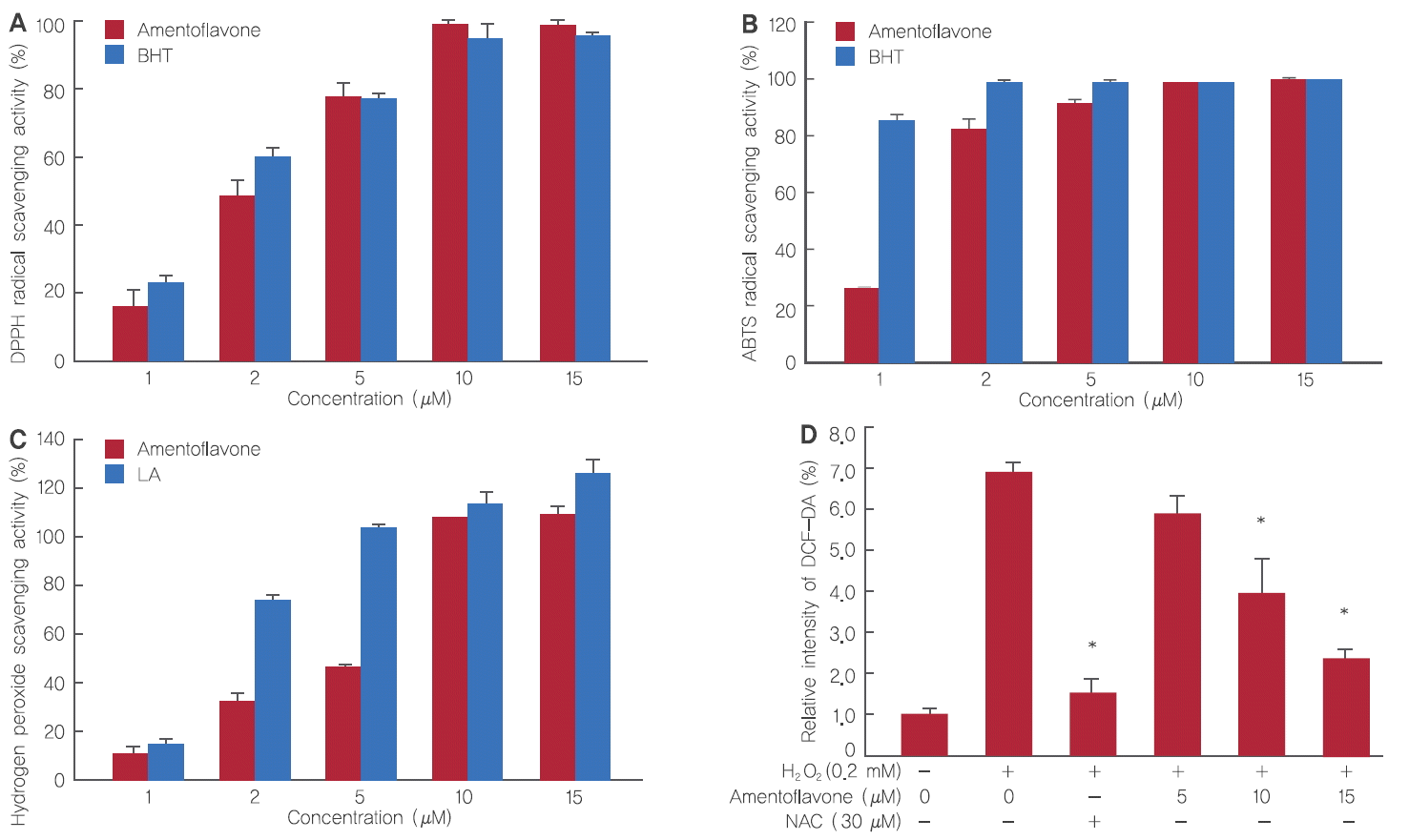
DPPH radical 소거작용은 항산화성 물질과 반응하여 수소원자를 받아들임으로써 산화를 억제시켜 항산화능의 정도를 측정하는 방법이다. H2O2에 의한 세포 생장 저해 및 사멸을 억제하는 amentoflavone의 항산화 효과를 확인한 결과, amentoflavone을 1, 2, 5, 10, 15 µM 처리 시 16.4%, 48.2%, 77.9%, 98.1%, 98.7%로 농도 의존적으로 항산화 효과가 증가하여 항산화 표준 물질로 알려진 BHT와 유사한 결과를 나타냄을 확인하였다(Figure 4A).
ABTS radical 소거작용은 산화방지제에 의해 ABTS+ 라디칼의 흡광도를 저해시키는 원리를 이용하는 방법이다. Amentoflavone의 항산화 효과는 positive control 그룹인 BHT를 1, 2, 5, 10, 15 µM 처리 시 85.4%, 99.8%, 99.2%, 99.7%, 100.7%로 나타났으며, amentoflavone은 26.4%, 82.1%, 91.3%, 98.6%, 100.4%로 농도 의존적으로 상승하였으며 DPPH 결과와 마찬가지로 BHT와 유사한 항산화 효과를 나타내었다(Figure 4B).
한편, amentoflavone의 H2O2에 대한 항산화 효과에 관련해서 positive control 그룹인 LA는 1, 2, 5, 10, 15 µM 처리 시 14.7%, 74.4%, 104.1%, 110.8%, 125.1%로 나타났으며, amentoflavone은 9.8%, 31.9%, 45.2%, 108.1%, 110.8%로 나타났다. Amentoflavone이 저농도에서는 그 효율이 LA보다 좋지 못하였으나, 농도가 높아질수록 비슷하거나 유사한 효과가 나타난 것을 확인하였다(Figure 4C).
HDFs에서 활성산소종 측정 방법인 DCF-DA assay는 세포 내의 산화과정을 통해 가장 보편적으로 사용되는 활성산소종 측정 방법이다. Amentoflavone이 H2O2에 의해 세포 내 발생하는 ROS의 억제 효능을 확인한 결과, HDFs에 H2O2를 0.2 mM 처리 시 H2O2를 처리하지 않았을 때보다 ROS가 6.8배 정도 증가하였으나 amentoflavone를 5, 10, 15 μM 처리 시 ROS는 6배, 4배, 2.3배로 농도 의존적으로 억제되었다. 그 결과 H2O2에 의해 생성된 세포 내 ROS를 amentoflavone이 효과적으로 제거함을 확인하였으며 본 실험의 양성 대조군인 ROS 소거능력이 뛰어난 NAC 30 μM 처리 시, 유사한 효과를 갖는 것을 확인함으로써 amentoflavone의 ROS scavenging effect가 유의적임을 알 수 있었다(Figure 4D).
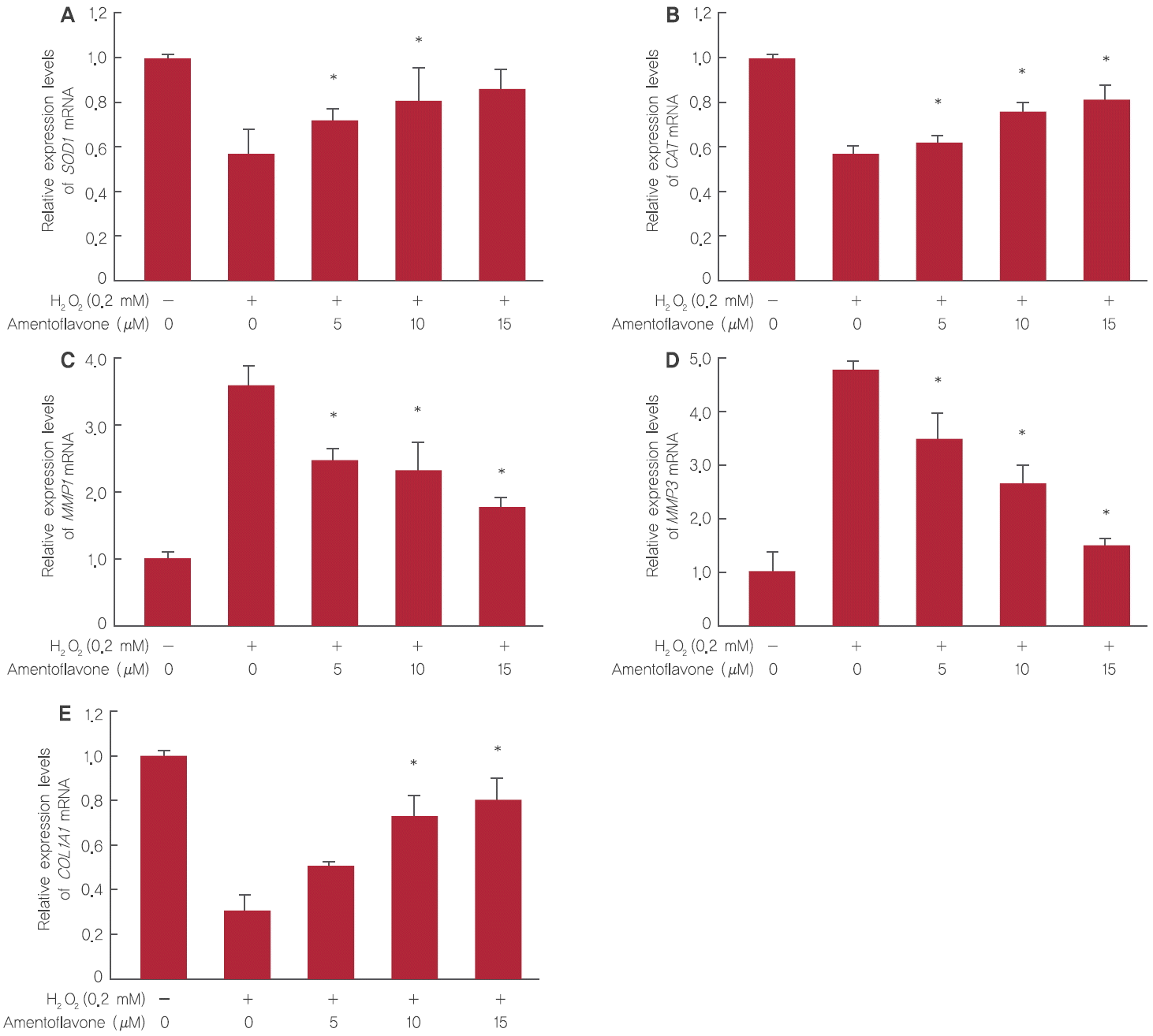
3. Effects of amentoflavone on antioxidant and antiwrinkle gene expression
노화 억제 기전에 있어 대표적 항산화 효소인 SOD1의 유전자 발현 변화를 확인한 결과, H2O2를 0.2 mM 처리 시 대조군에 비해 0.57배 감소하였으나 amentoflavone 5, 10, 15 μM 처리 시 0.72배, 0.80배, 0.86배로 회복됨을 확인하였다(Figure 5A). CAT mRNA의 경우, H2O2를 0.2 mM 처리 시 대조군에 비해 0.55배 감소하였으나 amentoflavone을 5, 10, 15 μM 처리 시 0.62배, 0.75배, 0.81배로 회복됨을 확인하였다(Figure 5B).
한편, 주름과 관련된 MMP1의 유전자 발현 변화 결과는 H2O2를 단독으로 0.2 mM 처리 시 H2O2와 amentoflavone을 모두 처리하지 않은 대조군에 비해 3.6배 이상 증가하는 것으로 나타났으나 amentoflavone을 5, 10, 15 µM로 처리하였을 때 MMP1의 발현양이 2.4배, 2.3배, 1.7배로 감소하였다(Figure 5C). 또한 MMP3 mRNA의 경우, H2O2만 0.2 mM 처리 시 H2O2와 amentoflavone을 모두 처리하지 않은 대조군에 비해 4.7배 이상 증가하는 것으로 나타났으나 amentoflavone을 5, 10, 15 µM로 처리하였을 때 MMP3의 발현양이 3.4배, 2.6배, 1.4배로 감소하였다(Figure 5D).
H2O2 산화적 스트레스 처리 시 세포는 다양한 신호전달에 의해 콜라겐 합성이 저해되는데 amentoflavone의 콜라겐 합성에 미치는 영향을 확인한 결과, H2O2를 0.2 mM 처리 시 COL1A1 mRNA의 발현은 대조군에 비해 0.30배 감소하였다. 그러나 amentoflavone을 5, 10, 15 µM로 전처리하고 H2O2를 0.2 mM 처리 시 COL1A1 mRNA의 발현양은 0.51배, 0.72배, 0.80배로 나타나 amentoflavone이 농도의존적으로 COL1A1의 유전자 발현을 증가시키는 것을 확인할 수 있었다(Figure 5E).
4. Antiaging effects of amentoflavone
Amentoflavone를 처리하지 않고 H2O2 0.2 mM을 처리 시 HDFs의 SA-β-galactosidase의 비율은 amentoflavone과 H2O2를 모두 처리하지 않은 대조군에 비해 66.4%로 증가하였다. 그러나 amentoflavone을 5, 10, 15 μM 농도로 전처리하고 H2O2를 0.2 mM로 처리한 경우 HDFs의 SA-β-galactosidase 비율은 52.7%, 41.9%, 26.1%로 현저히 감소하는 것을 확인하였다(Figure 6).
Conclusion
피부에 노화를 일으키는 다양한 이론 중 ROS는 세포막의 지질, 효소, 구조 단백질, DNA와 같은 분자의 손상은 물론, 질병과 노화를 가속시킨다. 피부의 진피층에 존재하는 HDFs에 ROS 종류인 H2O2를 처리하였으며, 본 연구에서는 항노화 기능성 화장품 원료로서의 가능성을 확인하기 위해 항암, 항염 효과가 우수한 biflavonoid의 종류 중 하나인 amentoflavone를 통해 항산화, 항노화 연구를 검증하였다.
Amentoflavone은 인간진피섬유아세포(human dermal fibroblast; HDFs)에 대한 독성은 없었으며, H2O2로 인한 세포 독성 상황에서도 amentoflavone을 처리 시 세포생존율이 증가함을 확인함으로써 amentoflavone이 세포 사멸 억제에 기여한다는 것을 확인할 수 있었다.
또한, amentoflavone의 항산화 효과를 확인하기 위하여 DPPH assay 및 ABTS assay를 수행한 결과, 두 실험 모두 농도 의존적으로 항산화 효과가 증가하여 대조군인 BHT와 유사한 효과를 나타냄을 확인하였다. H2O2 assay에서도 역시 대조군인 LA와 유사한 항산화 효과를 나타내었다. ROS detection assay와 관련하여, H2O2에 의해 증가된 ROS는 amentoflavone 5, 10, 15 µM 처리 시 6.0배, 4.0배, 2.3배로 농도 의존적으로 억제되었고 15 µM 농도에서 ROS 제거 능력은 NAC 30 µM과 유사한 수치로 나타났다.
항산화 효과를 유전자 수준에서도 확인해 본 결과, 대표적인 항산화 효소인 SOD1 mRNA 및 CAT mRNA 역시 H2O2에 의해 유전자 발현이 감소하였으나, amentoflavone 처리 시 농도 의존적으로 유전자 발현이 상승하였다. 이러한 결과를 통해 amentoflavone의 항산화 효과뿐만 아니라, 항산화 소재로서의 가능성도 확인 할 수 있었다. 항노화 연구와 관련하여 H2O2 처리 시 발현이 증가하는 MMP1, MMP3는 amentoflavone 처리 시 유전자 발현이 감소한 반면, H2O2에 의해 발현이 감소한 COL1A1 유전자는 amentoflavone 처리 시 발현이 증가하였다. 또한, SA-β-galactosidase의 세포노화 실험에서 농도 의존적으로 노화된 세포의 비율이 현저히 감소하였다.
이러한 결과는 amentoflavone이 H2O2에 의해 유도된 세포노화를 효과적으로 억제함을 보여주는 것이다. 이로써 amentoflavone이 ROS종의 하나인 H2O2의 산화적 스트레스로부터 피부를 효과적으로 보호하며, 항노화 화장품 소재로서 충분한 가능성이 있음을 보여주는 것이라 할 수 있다.