Embelin의 세포사멸 억제 및 항염 효능
Inhibition of Apoptosis and Anti-inflammatory Effects of Embelin
Embelin的细胞凋亡抑制以及抗炎作用
Article information
Abstract
목적
Embelin은 인도의 중요한 전통 약용 식물인 Embelia ribes Burm. (Myrsinaceae)의 주요 활성 성분으로 항암, 항염증 및 항산화 효과에 관련된 의약학 연구가 진행되었으나 화장품 원료 활용으로서의 연구는 전무한 실정이다. 그러므로 본 연구에서는 embelin의 세포사멸 억제, 항염 효능을 검증하여 화장품 소재로서의 가능성을 확인하고자 하였다.
방법
세포 생존율은 water soluble tetrazolium salt (WST-1) assay의 원리를 이용하여 측정하였다. Embelin에 의한 인간 진피섬유아세포 내에서 일어나는 세포사멸억제 효과와 항염 효과의 유전자 발현패턴을 정량적으로 분석하기 위하여 quantitative real time polymerase chain reaction (qRT-PCR)을 실행하였다. 세포사멸 정도를 확인하기 위해 Apoptosis ELISA kit를 사용하였고, 세포사멸 지표인 미토콘드리아 막전위차를 측정하기 위해 5,5', 6,6'-tetrachloro-1,1', 3,3'-tetraethylbenzimidazolylcarbocyanine iodide (JC-1) mitochondrial membrane potential detection kit를 사용하였다.
결과
WST-1 분석을 통해 과산화수소(H2O2)에 의한 감소된 세포 생존율이 embelin에 의해 농도 의존적으로 회복되는 것을 확인하였다. H2O2로 유도된 세포사멸이 embelin에 의해 회복되었고, 농도 의존적으로 세포 사멸을 촉진하는 BAX 유전자 발현은 감소하였으며 미토콘드리아 막전위차는 증가하였다. 이를 통해 embelin이 H2O2 처리된 인간 진피섬유아세포에서 세포사멸 억제 기능을 한다는 것을 확인하였다. H2O2 처리된 인간 진피섬유아세포에서 embelin의 항염증 효과를 알아보기 위해 염증을 유발하는 cyclooxygenase 2 (COX2), tumor necrosis factor α (TNFα), interleukin 6 (IL6)의 유전자 발현을 분석한 결과, embelin에 의해 농도 의존적으로 유의하게 감소하는 것을 확인하였다.
결론
Embelin이 세포사멸 억제 효능 및 항염 효능을 가진 항노화 화장품 성분으로서 활용 가능성이 있다고 판단된다.
Trans Abstract
Purpose
Embelin is a major active ingredient of Embelia ribes Burm, belonging to Myrsinaceae, and an important traditional medicinal plant of Indian origin. Embelin has been studied for anti-cancer, anti-inflammatory, and anti-oxidative effects. However, there have been no studies on the use of cosmetic raw materials for embelin. Therefore, in this study, we investigated the inhibition of apoptosis and the anti-inflammatory effect to confirm the possibility of embelin as a cosmetic material.
Methods
Cell viability was measured by using water-soluble tetrazolium salt (WST-1) assay. Quantitative real time polymerase chain reaction (qRT-PCR) was performed to quantitatively analyze the gene expression patterns of embelin-induced inhibition of apoptosis and anti-inflammatory effects in human dermal fibroblasts (HDFs). Apoptosis enzyme linked immunosorbent assay (ELISA) kit was used to confirm the degree of apoptosis. 5,5', 6,6'-tetrachloro-1,1', 3,3'-tetraethylbenzimidazolylcarbo cyanine iodide (JC-1) mitochondrial membrane potential detection kit was used to measure mitochondrial membrane potential.
Results
The WST-1 assay confirmed that the reduced cell viability by hydrogen peroxide (H2O2) was restored by embelin in a concentration-dependent manner. H2O2-induced apoptosis was restored by embelin, Bcl-2-associated X protein (BAX) gene expression was decreased and mitochondrial membrane potential difference was increased in a concentration dependent manner. It was confirmed that embelin inhibits apoptosis in HDFs treated with H2O2. In order to investigate the anti-inflammatory effect of embelin in H2O2-treated human dermal fibroblasts, gene expression of cyclooxygenase 2 (COX2), tumor necrosis factor α (TNFα), and interleukin 6 (IL6), which induce inflammation, was examined and found to be decreased by embelin in a concentration dependent manner.
Conclusion
These results suggest that embelin has a potential as an anti-aging cosmetic ingredient with inhibition of apoptosis and anti-inflammatory properties.
Trans Abstract
目的
Embelin是一种印度的重要传统药用植物Embelia ribes Burm. (Myrsinaceae)的主要活性成分,据医学研究报道具 有抗癌、抗炎症以及抗氧化作用,但作为化妆品原料的应用研究至今没有。因此通过调查embelin的细胞凋亡抑制以及 抗炎作用,探索作为化妆品原料的应用可行性。
方法
利用water soluble tetrazolium salt (WST-1) assay原理测定细胞生 存率;为了定量分析人真皮成纤维细胞内细胞凋亡抑制效果和抗炎效果的遗传因子的表达,利用quantitative real time polymerase chain reaction (qRT-PCR)来测定。利用Apoptosis ELISA kit确认细胞凋亡程度,为测定细胞凋亡标志,即, 线粒体膜电位差利用5,5', 6,6'-tetrachloro-1,1', 3,3'-tetraethylbenzimidazolylcarbocyanine iodide (JC-1) mitochondrial membrane potential detection kit来测定。
结果
通过WST-1确认因H2O2减少的细胞生存率由embelin根据浓度依赖性逐 渐恢复;因H2O2诱导细胞凋亡的细胞生存率由embelin根据浓度依赖性逐渐恢复,促进细胞凋亡的BAX遗传因子的表达 减少,线粒体膜电位差反而增加。通过以上研究确认embelin抑制H2O2处理的人真皮成纤维细胞的细胞凋亡。在H2O2处 理的人真皮成纤维细胞中,确认embelin的抗炎症效果,分析炎症诱发因子cyclooxygenase 2 (COX2)、tumor necrosis factor (TNFα)、interleukin 6 (IL6)等遗传因子表达,其结果发现利用embelin处理后,以上遗传因子根据浓度依赖性减 少。
结论
Embelin抑制细胞凋亡,具有抗炎作用,因此作为抗衰老化妆品原料充分具有可行性。
Introduction
세포가 감당하기에 지나치게 많은 활성산소가 생성될 경우 염증을 일으키게 된다(Wajant et al., 2003). 염증 반응에 관여하는 대표적인 전사인자인(Gomez-Nicola et al., 2010; Mazière et al., 1999; Nomoto et al., 2001) nuclear factor kappa B (NF-κB)는 평소 세포질에서 inhibitor kappa B (IκB)와 결합하여 비활성 상태로 존재하지만 ROS 증가와 같은 자극에 의해 IκB를 인산화 시켜 분해한다(Baeurle & Henkel, 1994). IκB로부터 분리된 NF-κB는 핵으로 이동하여 cyclooxygenase 2 (COX2), tumor necrosis factor-alpha (TNF-α), interleukin-6 (IL-6)와 같은 염증 반응을 유도하는 유전자의 발현을 촉진시킨다(Baeuerle, 1988; Longley et al., 1988).
또한 과도하게 생성된 reactive oxygen species (ROS)는 염증뿐만 아니라 세포사멸을 유발한다. 세포사멸 촉진 유전자인 BAX는 평상 시 미토콘드리아 외막에 dimer 형태로 결합하여 있지만 ROS와 같은 자극에 의해 활성화가 되면 미토콘드리아로부터 세포질로 cytochrome C가 방출되어 caspase 9와 caspase 3가 연쇄적으로 활성화된다. 활성화된 caspase 3에 의해 유전자 복구 효소인 poly ADP-Ribose polymerase (PARP)의 분리가 일어나 세포의 apoptosis가 유발된다(Kang et al.,2012; Lee et al., 2017; Lee et al., 2016).
Embelin은 인도의 중요한 전통 약용 식물인 Embelia ribes Burm. (Myrsinaceae)의 주요 활성 성분이다. 벤조퀴논 유도체의 구조를 가진 embelin은 항산화제, 항암제, 항염증제, 진통제, 구충제, 항균제 등 광범위한 생물학적 활성을 가지고 있다(Radhakrishana & Gnanamani, 2014). 그 동안 embelin의 연구동향을 보면 췌장암, 유방암 등 다양한 암에 대한 항암 효과 연구(Li et al., 2013; Mori et al., 2007)가 주를 이루고, 관절염에 대한 항염 효과 연구(Dharmapatni et al., 2015)와 간손상, 당뇨병에 대한 항산화 연구(Naik et al., 2013; Singh et al., 2009)가 있으며, 뇌세포 신경보호효과(Dhadde et al., 2016)에 대한 기타 연구가 보고되었다.
전 세계적으로 항노화에 대한 화장품 소재 개발 연구가 증가하고 있으며 embelin에 대한 의약학 분야에서의 항암, 항염 및 항산화 선행연구가 보고되었으나 embelin의 화장품 원료 활용으로서의 연구는 전무한 편이다. 따라서 본 연구를 통해 H2O2로 유도된 인간 진피섬유아세포(human dermal fibroblast, HDF)에서의 embelin의 세포사멸 억제,항염 효능을 규명함으로써 embelin의 항노화 화장품 원료로서의 활용 가능성을 검증하고자 한다.
Methods
1. 세포 배양
본 연구에서는 인간 진피섬유아세포(American Type Culture Collection, ATCC, USA)를 사용하였다. 세포배양은 Dulbecco’s Modified Eagle Medium (DMEM; HyCloneTM, GE Healthcare Life Sciences, USA)에 10% fetal bovine serum (FBS; HyCloneTM), 1% antibiotics (penicillin 100 IU/mL, streptomycin 100 μg/mL; InvitrogenTM, Thermo Fisher Scientific, USA)을 함유한 배지를 사용하였고, 37℃, 5% CO2가 유지되는 조건에서 배양하였다.
2. 시료 처리
Embelin (Sigma-Aldrich, USA)은 순수정제(>98%)된 분말형태로 구매하여 실험에 사용할 때는 적정 농도로 dimethyl sulfoxide (DMSO; Sigma-Aldrich)에 용해시켜 사용하였다. 세포배양접시에 인간 진피섬유아세포를 24 h 배양한 다음 embelin을 적정 농도로 배지에 첨가하여 24 h 동안 전처리한 후, H2O2를 일정한 농도로 처리하고 3 h 후 분석에 사용하였다.
3. Cell viability 측정
세포생존율(cell viability)은 WST-1 assay의 원리를 이용하여 측정하였다. 이는 세포 내의 미토콘드리아 탈수소효소(dehydrogenase)와 수용성의 tetrazolium salt가 반응하여 형성되는 발색물질인 formazan을 이용하여 세포생존율을 측정하는 방법이다. 96-well plate에 인간 진피섬유아세포(3×103 cells/well)를 100 μL씩 접종하여 24 h 배양한 다음 embelin을 각각 2.5, 5, 7.5, 10 μM 농도로 처리하고, 24 h 동안 추가 배양하였다. 세포배양 접시에 EZ-Cytox cell viability assay kit reagent (ItsBio, Korea) 10 μL를 첨가하여 1 h 동안 배양한 다음 microplate reader (Bio-Rad Laboratories, USA)를 사용하여 490 nm에서 흡광도를 측정하였으며, 이를 3회 반복적으로 수행하여 세포생존율 평균값과 표준편차를 도출하였다.
4. RNA 추출과 cDNA 제조
Trizol reagent (InvitrogenTM, USA)를 사용하여 세포배양이 끝난 세포를 용해한 다음 0.2 mL chloroform (Biopure, Canada)을 첨가하여 상온에서 반응시킨다. 12000 rpm, 4℃ 조건으로 20 min 원심분리를 하여 mRNA가 포함된 상등액과 단백질이 포함된 하등액의 층분리를 확인한다. 상등액은 0.5 mL isopropanol (Biopure)을 첨가하여 10 min 상온에 방치 후 12000 rpm, 4℃ 조건으로 원심분리를 하여 RNA를 침전시키고, 75% ethanol (Biopure)을 이용하여 세척한 다음 ethanol을 제거하고 상온에서 건조시켰다. Diethylpyrocarbonate (DEPC, Biopure) water로 건조된 mRNA를 녹여 실험에 사용하였고, 추출된 RNA는 MaestroNano® microspectrophotometer (Maestrogen, USA)을 이용하여 260/280 nm의 ratio 1.8 이상인 순도의 RNA만을 실험에 사용하였다.
cDNA는 PCR tube에 1 μg RNA, 0.5 ng oligo dT18, DEPC water를 total 10 μL로 제조한 다음 70℃에서 10 min 간 처리하여 RNA 변성을 유도한 후 M-MLV reverse transcriptase (Enzynomics, Korea)를 이용하여 37℃에서 1 h 동안 반응시켜 cDNA를 합성하였다.
5. qRT-PCR
Embelin에 의한 인간 진피섬유아세포 내에서 일어나는 유전자 발현패턴을 정량적으로 분석하기 위하여 qRT-PCR을 실행하였다. qRT-PCR은 PCR tube에 0.2 μM primers, 50 mM KCl, 20 mM Tris/HCl pH 8.4, 0.8 mM dNTP, 0.5U Extaq DNA polymerase, 3mM MgCl2, 1X SYBR green (InvitrogenTM)을 혼합하여 반응액을 제조하였고, Line-Gene K (BIOER, China)를 사용하여 PCR을 진행하였다. Melting curve로 PCR의 유효성을 검증하였고, β-actin 의 발현을 표준화하여 각 유전자의 발현을 비교하고 분석하였으며 실험에 사용된 primer는 Table 1과 같다.
6. 세포사멸 측정
세포사멸 정도를 확인하기 위해 Apoptosis ELISA kit (Roche Molecular Biochemicals, Germany)를 사용하였다. ELISA는 면역정량법으로 항체에 효소를 결합시켜 항원-항체반응을 확인하는 방법이다. 세포 접종(cell seeding) 후 24 h 배양하고 세포에 시료와 자극처리를 한 뒤 다시 24 h 동안 배양해준다. Kit에 포함된 lysis buffer 200 μL를 넣어 세포를 용해하고 원심분리를 한다. 상층액 20 μL를 anti-histone monoclonal antibody 80 μL와 반응시켜 1차 ELISA 반응을 유도한다(300 rpm 교반기, 상온, 2 h). 반응용액을 제거하고 incubation buffer 300 μL로 3번씩 헹구어 준다. 이어서 2차 anti-DNA monoclonal antibody 80 μL를 넣어 2차 반응을 시켜준다. 2,2′-Azino-bis (3-ethylbenzthiazoline-6-sulfonic acid) (ABTS, Sigma-Aldrich) 100 μL를 첨가하여 10–20 min 반응시킨 후 microplate reader를 사용하여 405 nm에서 반응 결과를 측정하였다.
7. ΔΨm determination
세포사멸 지표인 미토콘드리아 막전위차(mitochondrial membrane potential, ΔΨm)를 측정하기 위해 JC-1 mitochondrial membrane potential detection kit (Cayman chemical, USA)를 사용하였다. 정상 세포내에서의 JC-1 염색시약은 미토콘드리아에 red 형광을 띠며 축적되고, apoptosis가 일어난 세포에서는 세포질에 green 형광을 띤다. 세포 접종 후 24 h 배양하고 세포에 시료와 자극처리를 한 뒤 24 h 동안 추가 배양해준다. JC-1을 첨가하여 37℃, 20 min 동안 반응시킨 후, Dulbecco's Phosphate-Buffered Saline (DPBS; GIBCOTM, USA) buffer로 두 번 헹구어준다. Flow cytometer를 이용하여 형광값을 각각 측정한다(Red, excitation 550 nm, emission 600 nm; Green, excitation 485 nm, emission 535 nm). Red/Green fluorescence ratio를 측정하여 미토콘드리아 막전위차로 표기하였다.
8. 통계처리
본 연구의 모든 실험들은 동일한 조건하에 독립적으로 3회 반복 측정을 통해 수행하였으며, 실험결과는 평균±표준 편차로 나타내었다. 실험 결과는 Student's t-test로 검정하였고, p-value 값이 0.05, 0.01, 0.001 이하인 경우 통계적으로 유의하다고 분석하였다(*p <0.05, **p <0.01, ***p <0.001).
Results and Discussion
1. Embelin의 세포독성 및 세포보호 효과
1) Embelin의 세포독성
인간 진피섬유아세포에 embelin을 2.5, 5, 7.5, 10 μM 농도로 각각 처리하고 24 h 배양 후 세포 생존율을 측정하여 embelin의 세포 독성을 확인하였다. 그 결과 embelin의 농도에 따라 2.5 μM에서 97%, 5 μM에서 93%, 7.5 μM에서 86%의 세포 생존율을 보였으나, 10 μM에서는 세포 생존율이 67%까지 떨어져 세포독성이 있는 것으로 판단되어 이후 실험에서는 7.5 μM을 최대 사용농도로 적용하였다(Figure 1).

Cell cytotoxicity of embelin on HDFs.
HDFs were seeded on 96-well plate and incubated for 24 h. Then after, the cells were preprocessed with diverse concentrations of embelin. After further incubation for 24 h, the cellular toxicity was measured by WST-1. The graph represents the mean±standard deviation of the relative cell viability in each sample from triplicate experiments (*p<0.05). HDFs, human dermal fibroblasts; WST-1, water-soluble tetrazolium salt.
2) Embelin의 H2O2에 대한 세포보호 효과
H2O2에 의한 인간 진피섬유아세포의 손상으로부터 embelin의 보호 효과를 알아보기 위해서 embelin을 각각 2.5, 5, 7.5 μM의 농도로 각각 24 h 전처리한 다음 H2O2를 750 μM 처리하고 3 h 후 세포생존율 변화를 확인하였다. 인간 진피섬유아세포에 embelin을 처리하지 않고 H2O2 750 μM 처리 시 74%로 세포생존율이 감소하였으나 embelin을 2.5, 5, 7.5 μM 전처리 시 83%, 86%, 91%로 embelin에 의해 세포생존율이 농도 의존적으로 유의하게 회복되는 것을 확인하였다(Figure 2).

Cell viability on H2O2 in the HDFs pretreated with embelin.
HDFs were cultured in a 96-well plate for 24 h and additionally cells were treated with embelin for 24 h. After 3 h post-treatment with embelin, H2O2 was applied in HDFs. After 24 h, cell viability was measured by using WST-1 assay. The graph represents the mean±standard deviation of the relative cell viability in each sample from triplicate experiments (**p<0.01, ***p<0.001). HDFs, human dermal fibroblasts; WST-1, water-soluble tetrazolium salt.
2. Embelin의 세포사멸 억제 효과
1) ELISA 방법을 이용한 apoptosis 측정결과
H2O2에 의해 발생된 인간 진피섬유아세포 내 apoptosis가 embelin에 의해 억제되는지를 확인하기 위해 Apoptosis ELISA kit를 사용하였다. 면역 특이적 반응을 이용하여 anti-histone monoclonal antibody를 반응시켜 1차 반응을 유도하고, 이어서 anti-DNA monoclonal antibody를 이용하여 2차 반응을 시켜주고 ABTS를 첨가하여 반응을 시킨 후 405 nm에서 반응 결과를 측정하였다. 그 결과 750 μM H2O2에 의해 apoptosis가 1에서 5.12로 증가하였으나, embelin 2.5, 5, 7.5 μM 농도로 전처리 후 750 μM H2O2를 처리 시 apoptosis가 3.46, 1.74, 1.54로 감소하였다(Figure 3). 본 실험을 통해 결과적으로 embelin이 농도 의존적으로 apoptosis를 유의하게 감소시킴으로써 세포사멸 억제에 영향을 미치는 것으로 확인되었다.
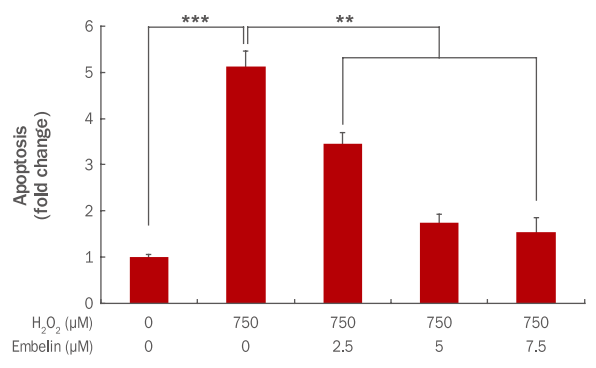
Inhibitory effect of apoptosis by embelin in H2O2-treated HDFs.
HDFs were cultured in a 60 mm culture dish for 24 h and additionally cells were treated with embelin for 24 h. At 3 h post treatment with 750 μM of H2O2, cells were further incubated for 24 h. H2O2-induced apoptosis was measured by Apoptosis ELISA kit. The total amount of apoptosis was decreased by embelin in a dose-dependent manner. The graph represents the mean±standard deviation of the apoptosis level in each sample from triplicate experiments (**p<0.01, ***p<0.001). HDFs, human dermal fibroblasts; ELISA, enzyme linked immunosorbent assay.
2) 미토콘드리아 막전위차 측정결과
세포사멸 지표인 미토콘드리아 막전위차 측정은 JC-1 mitochondrial membrane potential detection kit를 사용하였으며, flow cytometer를 이용하여 형광값을 각각 측정하였다. JC-1 염색은 미토콘드리아의 막전위 변화에 의해 정상세포일 경우 미토콘드리아 내로 들어가 다복합체를 형성하여 빨간색으로 나타나고, apoptosis가 일어나면 세포질에 남아 녹색을 나타낸다(Kim et al., 2011). Red/Green fluorescence ratio를 측정하여 미토콘드리아 막전위차로 표기한 결과 750 μM H2O2에 의해 ΔΨm이 1에서 0.48로 감소하였으나, embelin 2.5, 5, 7.5 μM 농도로 전처리 후 750 μM H2O2를 처리 시 ΔΨm이 0.75, 0.91, 0.96으로 유의하게 증가하였다(Figure 4).
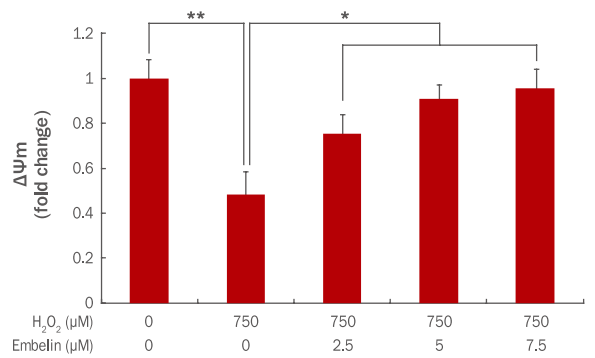
Restoration of ΔΨm by embelin in H2O2-treated HDFs.
HDFs were cultured in a 60 mm culture dish for 24 h and additionally cells were treated with embelin for 24 h. At 3 h post treatment with 750 μM of H2O2, cells were further incubated for 24 h. Then, ΔΨm was measured by JC-1 mitochondrial membrane potential detection kit. The total amount of ΔΨm was increased by embelin in a dose-dependent manner. The graph represents the mean±standard deviation of the ΔΨm level in each sample from triplicate experiments (*p<0.05, **p<0.01). ΔΨm, mitochondrial membrane potential; HDFs, human dermal fibroblasts; JC-1, 5,5',6,6'-tetrachloro-1,1',3,3'-tetraethylbenzimidazolylcarbocyanine iodide.
미토콘드리아는 에너지를 생성하기 위해 adenosine triphosphate (ATP)를 합성하는데 이때, 이온의 위치에너지를 이용한다. 때문에 미토콘드리아 막간공간에 양성자가 많이 분포되어 있고 막전위가 형성된다(Reece et al., 2012). 미토콘드리아 막투과성이 항진되면 막간공간에 존재하는 apoptosis 유도 단백질인 cytochrome C가 세포질에 방출되고, 방출된 cytochrome C는 단백질 분해효소 그룹인 caspase를 단계적으로 활성화하여 apoptosis가 실행된다(Kim et al., 2010). 본 실험을 통해 결과적으로 H2O2 처리 시 ΔΨm이 감소하였으나 embelin이 농도 의존적으로 ΔΨm을 증가시킴으로써 미토콘드리아의 기능 파괴를 막아 세포 사멸 억제에 영향을 미치는 것으로 보인다.
3) BAX 유전자 발현 변화
세포사멸을 촉진하는 BAX 유전자 발현에 embelin이 어떤 영향을 나타내는지 qRT-PCR을 통해 확인하였다. 그 결과 750 μM H2O2에 의해 BAX 유전자 발현이 1에서 2.96으로 증가하였으나, embelin 2.5, 5, 7.5 μM 전처리 후 750 μM H2O2를 처리 시 BAX 유전자 발현이 1.96, 1.37, 1.08로 유의하게 감소하였다(Figure 5).
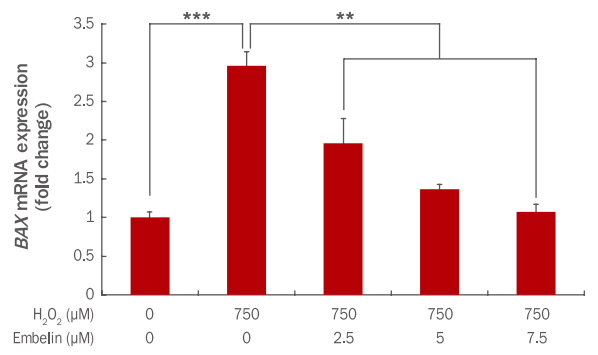
Inhibition of BAX gene expression by embelin in H2O2-treated HDFs.
HDFs were pre-treated for 24 h after adding embelin at indicated concentrations to a culture medium. At 3 h after the H2O2 treatment, changes of BAX gene expressions were examined by qRT-PCR. The BAX gene expression was decreased by embelin in a dose-dependent manner. The graph represents the mean±standard deviation of three independent experiments (**p<0.01, ***p<0.001). HDFs, human dermal fibroblasts; BAX, Bcl2-associated X protein; qRT-PCR, quantitative real time polymerase chain reaction.
BAX는 미토콘드리아 내의 cytochrome C를 세포질로 유출시켜 세포사멸을 촉진시키는 대표적인 pro-apoptotic 유전자이다(Han et al., 2008). 그러므로 embelin이 농도 의존적으로 세포사멸 촉진 유전자인 BAX 발현을 감소시킴으로써 세포사멸을 억제하는 것으로 사료된다.
3. Embelin의 항염 효과
1) COX2 유전자 발현 변화
인간 진피섬유아세포에서 embelin에 의한 COX2 유전자 발현 변화를 qRT-PCR을 통해 확인하였다. 그 결과 750 μM H2O2에 의해 COX2 유전자 발현이 1에서 4.84로 증가하였으나, embelin 2.5, 5, 7.5 μM 전처리 후 750 μM H2O2를 처리 시 COX2 유전자 발현이 2.44, 1.76, 1.52로 감소하였다(Figure 6).

Inhibition of COX2 gene expression by embelin in H2O2-treated HDFs.
HDFs were pre-treated for 24 h after adding embelin at indicated concentrations to a culture medium. At 3 h after the H2O2 treatment, changes of COX2 gene expressions were examined by qRT-PCR. The COX2 gene expression was decreased by embelin in a dose-dependent manner. The graph represents the mean±standard deviation of three independent experiments (*p<0.05, ***p<0.001). HDFs, human dermal fibroblasts; COX2, cyclooxygenase 2; qRT-PCR, quantitative real time polymerase chain reaction.
COX는 arachidonic acid로부터 prostaglandin을 생산하는 과정에서 작용하는 효소이며 COX1, COX2가 존재한다. 그 중 COX2는 염증을 포함한 다양한 자극인자에 의해 단기간 내에 급격히 발현되는 것으로 알려져 있다(Vane et al., 1998). 그러므로 embelin이 농도 의존적으로 염증유발 유전자인 COX2 발현을 감소시킴에 따라 염증매개 물질의 생성을 줄여 인간 진피섬유아세포 내 염증 발생 또한 감소될 것으로 판단된다.
2) TNFα 유전자 발현 변화
인간 진피섬유아세포에서 embelin에 의한 TNFα 유전자 발현변화를 qRT-PCR을 통해 확인하였다. 그 결과 750 μM H2O2에 의해 TNFα 유전자 발현이 1에서 4.79로 증가하였으나, embelin 2.5, 5, 7.5 μM 전처리 후 750 μM H2O2를 처리 시 TNFα 유전자 발현이 3.46, 1.92, 1.50으로 감소하였다(Figure 7).

Inhibition of TNFα gene expression by embelin in H2O2-treated HDFs.
HDFs were pre-treated for 24 h after adding embelin at indicated concentrations to a culture medium. At 3 h after the H2O2 treatment, changes of TNFα gene expressions were examined by qRT-PCR. The TNFα gene expression was decreased by embelin in a dose-dependent manner. The graph represents the mean±standard deviation of three independent experiments (*p<0.05, ***p<0.001). HDFs, human dermal fibroblasst; TNFα, tumor necrosis factor α; qRT-PCR, quantitative real time polymerase chain reaction.
IL1β과 함께 염증반응 초기에 작용하는 cytokine인 TNFα는 스트레스 상태에서 염증반응의 결정적인 매개체 역할을 한다(Ventura et al., 2003). 또한 급성 염증반응에서 중요한 역할을 하는 염증성 질환의 주요 조절인자이자 종양 발생 시에 세포괴사(necrosis)를 유도하여 종양 발생의 감시 기전으로 사용되기도 한다(Aqarwal et al., 1988). 그러므로 embelin이 농도 의존적으로 급성 염증반응의 주요 조절인자인 TNFα 발현을 감소시킴으로써 인간 진피섬유아세포 내 급성 염증반응 또한 억제될 것으로 판단된다.
3) IL6 유전자 발현 변화
인간 진피섬유아세포에서 embelin에 의한 IL6 유전자의 발현변화를 qRT-PCR을 통해 확인하였다. 그 결과 750 μM H2O2에 의해 IL6 유전자 발현이 1에서 3.48로 증가하였으나, embelin 2.5, 5, 7.5 μM 전처리 후 750 μM H2O2를 처리 시 IL6 유전자 발현이 2.61, 1.78, 1.39로 감소하였다(Figure 8).
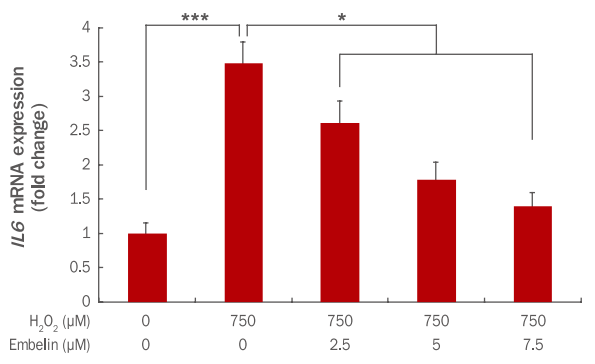
Inhibition of IL6 gene expression by embelin H2O2-treated HDFs.
HDFs were pre-treated for 24 h after adding embelin at indicated concentrations to a culture medium. At 3 h after the H2O2 treatment, changes of IL6 gene expressions were examined by qRTPCR. The IL6 gene expression was decreased by embelin in a dosedependent manner. The graph represents the mean±standard deviation of three independent experiments (*p<0.05, ***p<0.001). HDF, human dermal fibroblast; IL6, interleukin 6; qRT-PCR, quantitative real time polymerase chain reaction.
IL6는 다양한 기능을 하는 cytokine으로 염증반응과 면역반응을 매개하는 것으로 잘 알려져 있다(Pang et al., 1994; Zhai et al., 2001). 또한 염증 시 과잉 생산되어 염증 정도를 나타내는 지표로도 이용된다(Hirano et al., 1986; Frydas et al., 1996). 그러므로 embelin이 농도 의존적으로 염증 지표로 이용되는 IL6 발현을 감소시킴으로써 인간 진피섬유아세포 내 염증반응 또한 억제될 것으로 판단된다.
Conclusion
전 세계적으로 항노화 화장품에 대한 소재 개발 연구가 증가하고 있으며, embelin에 대한 의·약학 분야에서의 항암, 항염 및 항산화 선행연구가 보고되었으나 embelin의 화장품 원료 활용으로의 연구는 전무한 편이다. 따라서 본 연구에서는 embelin의 항노화 화장품 원료로서의 가능성을 확인하기 위하여 인간 진피섬유아세포에 embelin을 농도별 전처리 후 H2O2로 산화적 스트레스를 유도한 다음 이로 인해 나타나는 세포의 변화를 통해 embelin의 세포사멸 억제, 항염 효과를 확인하였다.
첫째, 인간 진피섬유아세포에서 embelin의 세포독성 및 H2O2에 대한 세포보호 효과를 알아보았다. 그 결과 embelin을 2.5, 5, 7.5 μM 농도로 각각 처리 시 97%, 93%, 86%의 생존율을 보였으나, 10 μM 농도에서 세포 생존율이 67%까지 떨어져 세포독성이 있는 것으로 판단되었다. 이후 실험에서는 7.5 μM을 최대 사용농도로 적용하였다. 또한 인간 진피섬유아세포에 embelin을 각각 2.5, 5, 7.5 μM의 농도로 전처리 후 H2O2를 750 μM 처리한 경우 세포 생존율이 농도 의존적으로 회복되는 것을 확인하였다.
둘째, 인간 진피섬유아세포에서 embelin의 세포사멸 억제 효과를 확인하였다. H2O2에 의해 발생된 인간 진피섬유아세포 내 세포사멸이 embelin에 의해 억제되는지를 확인한 결과, embelin이 농도 의존적으로 세포사멸을 감소시키고, 세포사멸 지표인 미토콘드리아 막전위차를 증가시켰다. 또한 embelin은 세포사멸을 촉진하는 대표 유전자인 BAX의 발현량을 감소시켜 미토콘드리아로부터 세포질로 cytochrome C가 방출되는 것을 억제함으로써 세포사멸 억제효과가 있음을 확인하였다.
셋째, 인간 진피섬유아세포에서 embelin의 항염 효과를 확인하였다. Embelin의 농도가 증가할수록 대표적인 염증반응 전사인자인 NF-κB 하위 유전자인 COX2, TNFα, IL6 의 염증 유발 유전자 발현이 감소하는 것을 확인하였다.
본 연구결과를 통해 embelin은 농도 의존적으로 H2O2에 의해 손상된 인간 진피섬유아세포의 세포생존율을 회복시키고, 세포사멸 억제 및 항염 효과가 있음을 확인하였다. 그러므로 embelin은 인간 진피섬유아세포의 항노화 효능을 가진 화장품 소재로서 활용가능 하리라고 판단된다. 다만 이번 연구결과를 검증하기 위한 임상실험에서의 추가 연구가 필요하다고 사료된다.
Acknowledgements
이 논문은 해양수산부의 재원으로 해양생명공학기술개발사업(과제번호: 20150184) 연구개발비 지원에 의해 수행되었습니다.