아세틸글루타민의 피부세포 노화억제 및 피부장벽 기능 강화효과
Effects of Acetyl Glutamine on the Improvement of Skin Barrier and Inhibition of Senescence
乙酰谷氨酰胺抑制皮肤细胞老化以及增强皮肤屏障功能
Article information
Abstract
목적
본 연구는 화장품 원료로서 아세틸글루타민의 피부세포 노화억제 및 피부장벽 기능 강화효과를 세포 효력시험을 통해 검증하는데 목적이 있다.
방법
아세틸글루타민의 세포효력을 검증하기 위하여 세포생존율, SA-β-galactosidase assay, Western blotting, quantitative real-time PCR을 실시하였다.
결과
아세틸글루타민은 인간 각질형성세포주 (HaCaT)와 인간 진피섬유아세포(human dermal fibroblast, HDF)에 대한 독성이 없었으며, 아세틸글루타민 20 mM 처리 시 100, 200 μM의 H2O2에 의해서 감소된 각각의 세포 생존율이 증가하였다. HaCaT에 H2O2를 처리하여 유도된 세포노화 실험에서 20 mM 농도의 아세틸글루타민이 글루타민보다 노화된 세포를 더 많이 감소시켰다. 아세틸글루타민 20 mM 처리 시 글루타민보다 keratin 1과 involucrin의 발현이 현저하게 증가하여 아세틸글루타민이 각질형성세포의 분화를 촉진하는 효력이 더 우수함을 확인했다. 아세틸글루타민은 또한 H2O2에 의해서 활성화되는 대표적 전사인자인 p53이 핵 내에 축적되는 것을 저해하고, p53에 의해서 발현되는 p21의 양도 감소시켰다. H2O2 처리 시 발현이 증가하는 MMP1 유전자는 아세틸글루타민 처리 시 발현이 감소하였고, 반면 H2O2에 의해 발현이 감소한 COL1A1 유전자는 아세틸글루타민에 의해서 발현이 증가하였다. 이러한 결과는 아세틸글루타민이 H2O2에 의해 유도된 세포노화를 효과적으로 억제함을 보여주는 것이다.
결론
이상과 같이 아세틸글루타민의 피부세포 노화억제 및 피부장벽 기능 강화 효과를 검증하였고, 화장품 원료로서 충분한 가치가 있다고 사료된다.
Trans Abstract
Purpose
The purpose of this work is to investigate the effects of acetyl glutamine (NAG) as a cosmetic ingredient-the effect of the inhibition of senescence and enhancing skin barrier-through cell-based assays.
Methods
We confirmed the effects of NAG using cell viability, SA-β-galactosidase assay, western blotting and quantitative real-time PCR.
Results
NAG did not affect cell viability. NAG at 20 mM showed a significant protective effect against H2O2-induced loss of cell viability at 100, 200 μM. It was found that 20 mM NAG reduced senescence cells in H2O2-induced HaCaT far more than glutamine (Gln) in SA-β-gal positive cells. NAG at 20 mM increased expressions of keratin 1 and involucrin remarkably more than Gln. It indicates that NAG has better efficacy in facilitating differentiation of epidermal keratinocyte than Gln. Also, NAG reduced nuclear accumulation of p53, a homotetrameric transcription factor, and expression of p21 in HDFs with H2O2. NAG decreases expression levels of matrix metallopeptidase 1 (MMP1) mRNA in HDFs with H2O2. The H2O2-induced decrease in the levels of collagen, type I, alpha 1 (COL1A1) expression were significantly increased by treatment with NAG. The result indicates that NAG effectively controls senescence cells triggered by H2O2. As a result, it was found that NAG was effective in maintaining moisture of stratum corneum, the most important function of skin barrier.
Conclusion
As shown earlier, this work tested NAG's effects of the inhibition of senescence and enhancing skin barrier. These findings suggest that NAG might be used as a cosmetic ingredient.
Trans Abstract
目的
通过细胞活力测试验证乙酰谷氨酰胺(acetyl glutamine,NAG)对皮肤细胞衰老抑制和皮肤屏障功能作为化妆品原料的作用。
方法
为测量NAG的细胞功效,进行细胞生存率测定,SA-β-半乳糖苷酶测定,蛋白质印迹和定量实时PCR。
结果
NAG对人角质形成细胞系(HaCaT)和人皮肤成纤维细胞(HDF)无毒。被100,200 μM H2O2处理而减少的细胞生存率,利用20 mM的NAG处理时,其细胞生存率逐渐增加。发现20 mM NAG 减少H2O2诱导的HaCaT中的衰老细胞远远超过谷氨酰胺(glutamine,Gln)。20 mM的NAG增加 keratin 1和 involucrin的表达显着高于Gln。这表明NAG比Gln具有更好的促进表皮角质形成细胞分化的功效。此外,NAG 还减少了p53(一种同源四聚体转录因子)的核积累,同时减少由p53表达的p21的量。NAG降低由H2O2诱导增加的基质金属肽酶1(matrix metallopeptidase 1,MMP1 )mRNA的表达水平,反而增加了由H2O2诱导降低的 collagen, type I, alpha 1 (COL1A1)表达水平。结果表明NAG有效控制H2O2触发的衰老细胞。
结论
如上所述,已显示NAG抑制皮肤细胞衰老并增强皮肤屏障功能,并且被认为具有作为化妆品原料充分具有价值。
Introduction
피부는 인체에서 가장 큰 기관이며 신체의 표면을 덮고 있는 조직으로 크게 표피와 진피로 구분된다. 또한 외부환경에 대한 보호 장벽으로서 몸을 보호하는 역할을 하며(Kim et al., 2009), 면역반응을 나타내는 대표적인 장기이다(Jeong et al., 2012). 그 중 표피는 매우 복잡하고 역동적이며 자기재생적인 피부장벽으로(Seo, 2012), 세포의 형성, 분화 및 탈각과정이 끊임없이 반복되면서 표피의 항상성을 유지한다(Park, 2007). 표피의 주요 구성세포는 각질형성세포로 분화 정도에 따라 기저층, 유극층, 과립층, 각질층의 4개 층으로 나뉜다. 피부장벽은 표피층의 분화과정을 통해 형성되며, 표피의 가장 윗 층인 각질층은 피부장벽 기능 중 가장 중요한 수분손실 방지와 외부 유해물질의 침입을 막는 방어막 역할을 한다(Kwon et al., 2007).
표피에서의 세포확산은 기저층의 표피 줄기세포에서 이루어진다(Seo, 2012). 각질형성세포의 분화과정(differentiation)은 정교하게 조절 받는 유전자발현 변화의 결과로서 분화 단계별 표지 유전자(marker gene)들의 발현 조절 연구는 표피 분화과정의 기작을 밝히는데 중요한 역할을 한다. 기저층에서는 keratin 5와 14가 발현되는데 분화과정으로 이행하면 발현이 중단된다(quoted in Kim et al, 2004). 기저층 위에서는 keratin 1과 10을 유극층 및 과립층에서는 각질세포막 연관 단백질인 involucrin, loricrin, envoplakin 등이 합성된다(Park, 2007; Choi & Oh, 2008). 각질세포막은 분화과정의 마지막 단계에서 형성되는데 각질세포 단백질외막내의 involucrin 복합체는 각질 단백막을 둘러싸는 지질막을 형성한다(Kim et al., 2013b).
피부 보습에 중요한 각질층의 수분함량이 저하되면 건조증상과 피부장벽 기능의 이상이 나타나는데, 보습제는 각질층내의 수분 유지와 대사 작용이 원활하게 이루어지도록 도와주는 역할을 한다(Chang et al., 2007). 최근 피부 보습제는 그 유효성이 건조증상의 호전에서부터 피부노화의 개선에 이르기까지 다양하다. 또한 장기간의 보습제 도포가 피부장벽 기능을 향상시키고 중지한 후에도 정상적인 피부장벽 기능을 방해(down regulation)하지 않는다(Lee et al., 2011)는 보고가 있다.
건강한 피부 상태의 유지를 위해서 각질층은 약 30% 정도의 수분을 함유해야 하며, 아미노산은 피부의 보습상태에 중요한 역할을 한다는 연구가 다수 보고되었다(Kim et al., 2013a). NMF의 주성분인 아미노산의 함량은 보습과 관련한 각질의 생리기능과 밀접한 관련이 있고, 아미노산의 함량이 높을수록 보습유지에 효과적이라는 보고가 있다(Joo et al., 2012). 이와 같이 아미노산은 대표적인 보습성분으로서 피부각질층의 수분보유 능력에 중요한 NMF 중 약 40%를 차지하는데(Park et al., 2003) 글루타민(L-glutamine)은 NMF의 중요한 아미노산 성분 중 하나이다.
글루타민(L-glutamine, Gln)은 체내에 가장 많이 존재하는 조건적 필수 아미노산으로 단백질 합성과 세포내 에너지원으로 활용된다. 글루타민은 심각한 질병상태에서 농도가 감소되기 때문에 치료 시 필수적이며(Agostini & Biolo, 2010), 세포증식, 유전자 발현조절(Brasse-Lagnel et al., 2009), 단백질 합성(Newsholme et al., 2003), 항염증 작용(Zhang et al., 2008), 면역기능 조절(Singleton et al., 2005), 항산화 작용(Wischmeyer, 2008), 뇌세포 에너지원(Choi et al., 2005), 알레르기성 접촉성 피부염 억제와 전신적인 과민성 알레르기 질환인 후기 아나필락시스 억제 등의 효과가 보고되어져 있다.
아세틸글루타민(N-Acetyl L-glutamine)은 글루타민의 amine기에 acetyl 기가 결합 된 것으로 글루타민에 비해 화학적 안정성이 높고, 특히 물에서 더 안정적으로 존재하고 세포 내에서 글루타민과 거의 유사한 대사과정을 거치면서, 글루타민에 비하여 세포에 처리 시 초기에 안정적인 물질로 활용된다(Yoon et al., 2013; Yoon, 2013).
본 연구에서는 산화적 스트레스가 유도된 인간 피부세포에서 아세틸글루타민의 세포노화 억제 및 각질형성세포 분화조절 효과를 세포효력시험을 통해 검증함으로써 아세틸글루타민의 항노화 및 피부장벽 기능 강화 화장품 원료로서의 응용가능성을 제시하고자 한다.
Methods
1. 세포배양 및 시료처리
본 연구에서는 인간 각질형성세포주(HaCaT; ATCC, USA)와 인간 진피섬유아세포(human dermal fibroblasts, HDFs; Lonza, USA)를 사용하였다. HaCaT, HDFs의 배양에는 10% fetal bovine serum (FBS)과 1% penicillin/streptomycin이 첨가된 DMEM 배지(Welgene, Korea)를 사용하였으며 37℃, 5% CO2 조건에서 배양하였다. 세포 실험에서 사용된 glutamine (Gln)과 N-Acetyl glutamine (NAG; Sigma, USA)은 DMSO에 녹여 사용하였다. Cell culture dish에 HaCaT과 HDFs (1×106)를 24 h 배양한 후 Gln, NAG를 배지에 첨가하여 2 h 동안 전 처리하였다. 전처리 후 배지를 제거하고 phosphate-buffered saline (PBS)로 2회 세척한 뒤, 배지에 혼합된 Gln, NAG과 H2O2를 2 h 동안 처리한 후 PBS로 세척하였다. 그 후 Gln, NAG만 새로운 배지에 첨가하여 24 h 배양하고 실험을 실시하였다.
2. 세포 생존율
Cell viability 측정 실험에는 WST-1 assay 원리를 이용한 EZ-Cytox cell viability assay kit (이츠바이오, Korea)를 사용하였다. HaCaT, HDFs (3×103)를 96-well plate에 배양하고, 24 h 후 well당 Gln, NAG과 H2O2를 각각 0.002, 0.02, 0.2, 2, 20, 200 mM과 60, 80, 100, 200, 400, 600, 800 μM의 농도로 처리하여 24 h 배양하였다. 배양된 세포에 kit reagent를 10 μL 첨가하여 1 h 배양 후 microplate reader (Bio-Rad, USA)를 이용하여 490 nm의 파장에서 흡광도를 측정하였다. Cell viability 측정은 3회 반복으로 실시하였으며, 수행한 실험 결과에서 대조군과 실험군을 비교하여 나타내었다.
3. 세포 노화 측정
Senescence detection kit (Biovision, USA)를 사용하였으며, 세포 노화 측정의 바이오마커인 β-galactosidase의 활성 측정법인 SA-β-galactosidase assay를 이용하였다. HaCaT (1×106)을 60 mm culture dish에 접종하여 24 h 동안 배양하여 안정화 시킨 후 Gln, NAG 20 mM을 각각 전처리하고, H2O2 100 μM를 처리한 후 다시 24 h 배양하였다. 배양된 세포는 배지 제거 후 1 mL PBS로 1회 세척하고, 0.5 mL fixing solution을 첨가 후 상온에서 15 min 방치하여 고정화 하였다. 고정된 세포는 1 mL PBS로 2번 세척한 후 staining solution mix (staining solution 470 μL, staining supplement 5 μL, 20 mg/mL X-Gal in dimethylformamide 25 μL)를 0.5 mL씩 첨가하고 37℃에서 24 h 동안 배양하여 염색하였다. 염색된 세포는 1 mL PBS로 세척 후 1 mL 70% glycerol을 넣고 광학현미경(Olympus, Japan)을 통하여 세포 수를 측정하였다. 세포의 노화 정도는 전체 세포 수와 염색된 세포 수를 비교하여 노화된 세포(senescent cell)의 비율을 퍼센트로 나타내어 확인하였다.
4. Western blotting
Gln, NAG과 H2O2를 적정 농도로 처리 후 24 h 배양한 HaCaT을 수확하여 PBS로 세척 후 RIPA buffer (50mM Tris-Cl (pH 7.5), 50 mM NaCl, 1% NP-40, 0.5% sodium deoxycholate, 0.1% SDS, protease inhibitor cocktail (Roche, Switzerland))로 30 min간 세포를 용해하였다. 용해된 세포는 4℃에서 12,000 g으로 30 min간 원심분리하여 상등액을 회수한 후, SDS sample buffer (60 mM Tris (pH 6.8), 14.4 mM 2-mercaptoethanol, 25% glycerol, 2% SDS, 0.1% bromophenol blue)를 첨가하고 100℃에서 5 min 끓여 단백질을 denaturation 시킨 후 단백질을 SDS-PAGE로 분자량별로 분리하였다. 분리된 단백질은 100 V의 조건에서 1 h 동안 nitrocellulose membrane (Whatman, UK)으로 transfer 한 후, membrane을 5% skim milk 용액에서 1 h 동안 교반하여 blocking 하였다. 그 후 membrane에 primary antibody 용액을 처리하여 4℃에서 18 h 동안 교반한 후 TBS/T (10 mM Tris-Cl (pH 7.5), 150 mM NaCl, 0.2% Tween 20)로 5 min씩 3회 세척하였다. 세척된 membrane에 화학적 형광을 낼 수 있는 horseradish peroxidase (HRP)가 결합되어 있는 secondary antibody 용액을 상온에서 2 h 처리 후 다시 TBS/T로 5 min씩 3회 세척하였다. Secondary antibody가 처리된 membrane은 super signal west pico solution (Pierce, USA)를 처리하고 실험용 필름(Konica, Japan)에 감광을 유도한 후 감광된 필름을 자동현상기(QX-130II, Konica)를 이용하여 현상하여 단백질 band의 변화를 관찰하였다. Antibody는 β-actin, involucrin primary antibody (Sigma); p53, p21 primary antibody (Santa Cruz, USA); keratin 1 primary antibody (Covance, USA)를 사용하였다.
5. RNA 추출과 cDNA 제조
시료가 처리된 세포에서의 RNA 추출은 phenol 성분이 첨가된 Trizol reagent (Invitrogen, USA)를 이용하여 시행하였다. 수확한 세포가 들어있는 tube에 1 mL Trizol reagent를 넣고 상온에서 5 min 세포를 용해하였다. 여기에 0.2 mL chloroform (Biopure, Canada)을 첨가하고 강하게 15 s 흔들어 준 뒤 3 min 상온에 방치하고 12,000 g, 4℃의 조건에서 20 min 원심분리를 실시하여 RNA 층을 분리하였다. 분리된 RNA 층에 0.5 mL isopropanol (Biopure)을 첨가하여 상온에서 10 min 방치 후, 12,000 g, 4℃의 조건으로 15 min 원심분리를 실시하여 RNA를 침전시켰다. 침전된 RNA는 75% ethanol로 세척하고 상온에서 건조한 후 diethylpyrocarbonate (DEPC) water로 녹여 실험에 사용하였다. RNA의 순도는 Nanodrop (Nanodrop, USA)을 이용하여 측정된 260 nm/280 nm의 ratio를 통해 확인하였으며, ratio 1.8 이상의 RNA 만을 실험에 사용하였다. PCR 실험에 사용하기 위한 cDNA는 M-MLV reverse transcriptase (Enzynomics, Korea)을 사용하여 제조하였다. 1 μg RNA와 0.5 ng oligo dT18에 DEPC water를 첨가한 10 μL의 용액을 70℃에서 10 min 처리하여 RNA를 denaturation 시켰다. 여기에 buffer, 10 mM dNTP, 200 unit/μL reverse transcriptase를 첨가하여 37℃에서 1 h 반응시켜 cDNA를 제조하여 실험에 사용하였다.
6. Quantitative real-time PCR
Gln, NAG에 의해 세포 내에서 일어나는 유전자 발현 변화를 정량적으로 확인하기 위하여 quantitative RT-PCR (qRT-PCR)을 실시하였으며, SYBR 염색 기법에 사용되는 EvaGreen dye를 적용하여 결과를 확인하였다. qRT-PCR은 HOT FIREPol EvaGreen PCR Mix Plus (Solis BioDyne, Estonia), 1 pmole forward primer, 1 pmole reverse primer, 10 ng cDNA를 혼합하여 반응액을 제조 후 Linegene K (BioER, China)를 이용하여 진행하였으며, 세부 과정은 다음과 같다. 94℃에서 5 min denaturation 시킨 후 94℃에서 denaturation, 60℃에서 annealing, 72℃에서 polymerization 과정을 각각 30 s 수행하여 총 40 cycle 동안 반복하여 실시하였다. PCR 결과의 검증은 각 결과별 melting curve로 검증하였으며, 결과는 각 유전자의 threshold cycle (Ct) 값을 β-actin의 Ct 값으로 표준화한 후 Ct 값의 변화량을 비교하여 분석하였다. Ct 값은 PCR 산물에 의해 발생하는 형광 값이 일정한 기준값에 도달했을 때의 증폭 주기를 나타낸 것으로 대조군의 Ct 값과의 비교를 통해 실험군의 유전자 발현량을 확인할 수 있다. 실험에 사용된 각 유전자의 primer는 Table 1과 같다.
Results and Discussion
1. 인간 각질형성세포에 대한 독성
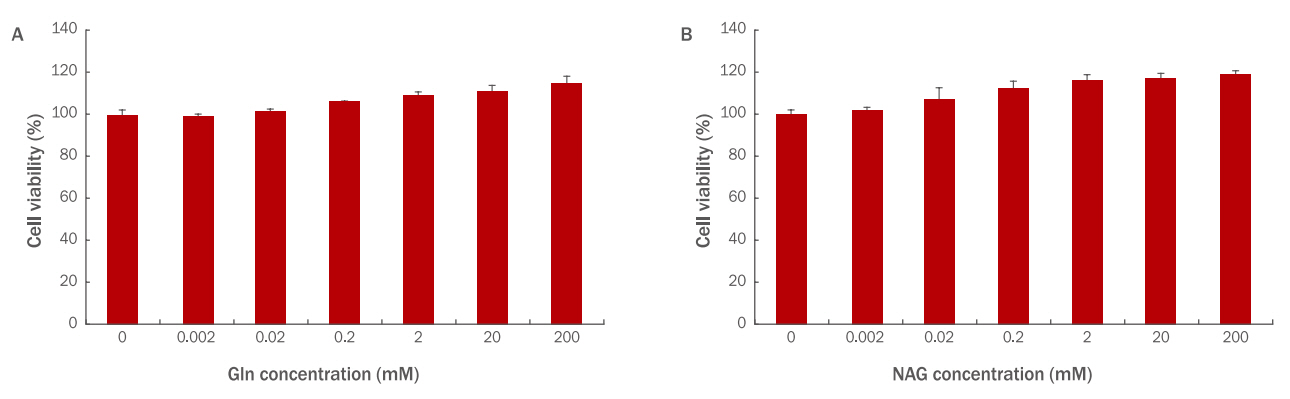
HaCaT에 Gln과 NAG를 각각 0.002, 0.02, 0.2, 2, 20, 200 mM 농도로 24 h 처리하여 세포 독성을 확인한 결과, 두 시료 모두 독성이 없는 것으로 확인되었다. 특히 Gln 200 mM 처리 시에는 111%, NAG 200 mM 처리 시에는 118%로 NAG의 세포 생존율이 더 높았으며 다른 농도에서도 전반적으로 NAG의 생존율이 더 높았다(Figure 1).
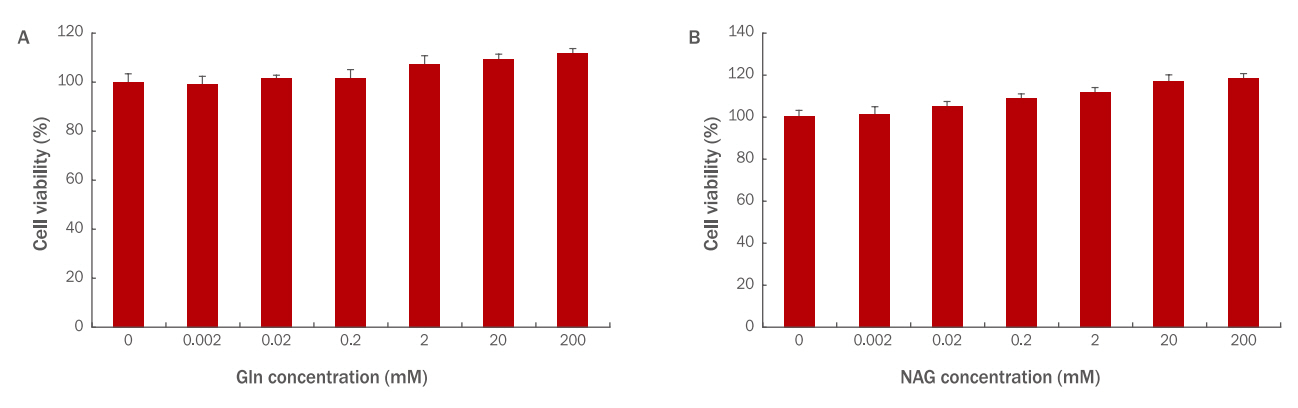
Cytotoxicity of Gln (A) and NAG (B) on HaCaT.
Cell viability of Gln and NAG on HaCaT (3×103) was measured by the WST-1 assay. (A) Gln was non-toxic to HaCaT at the 0.002, 0.02, 0.2, 2, 20, and 200 mM concentrations. (B) NAG was non-toxic to HaCaT at the 0.002, 0.02, 0.2, 2, 20, and 200 mM concentrations. Gln, glutamine; NAG, acetyl glutamine; WST, water-soluble tetrazolium salt; M±S.D., mean±standard deviation.
2. 인간 각질형성세포 보호효과
본 시험에서는 NAG의 H2O2에 대한 HaCaT 보호효과를 알아보기위해 H2O2를 사용하여 산화적 스트레스를 유도하고 세포 생존률 변화를 확인하였다. HaCaT에 H2O2를 각 60, 80, 100, 200, 400, 600, 800 μM로 처리할 경우 100 μM의 농도에서 76%의 생존율을 보였기 때문에 HaCaT 에서의 H2O2 적용 농도는 100 μM로 설정하였다(Figure 2A). Gln, NAG를 2, 20, 200 mM 전처리 후 H2O2 100 μM을 처리하여 세포 생존율 변화를 확인한 결과 Gln과 NAG 모두 농도 의존적으로 세포 생존율을 회복시킴을 알 수 있었다. Gln 2 mM은 88%, 20 mM은 91%, 200 mM은 93%의 생존율을 보였으며, NAG 2 mM은 94%, 20 mM은 98%, 200 mM은 99%의 생존율을 보였다. 이를 통해 Gln과 NAG 모두 20 mM 이상의 농도에서는 생존율의 변화가 거의 없음을 알 수 있었고, NAG가 H2O2에 의해서 저하된 세포 생존율을 더욱 효과적으로 증가시킴을 알 수 있다(Figure 2B). 따라서 이후 실험에서는 Gln과 NAG 모두 20 mM의 농도에서 효능을 확인하였다.
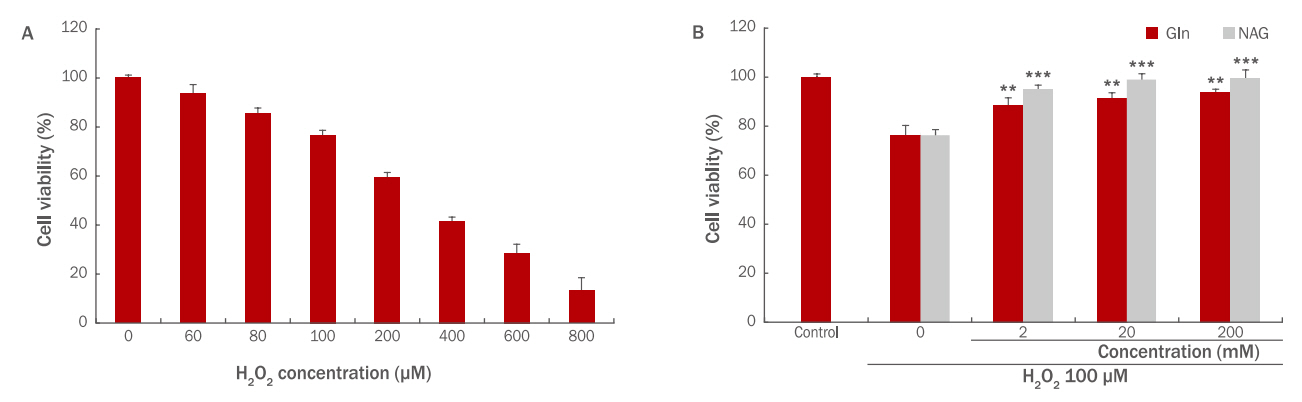
The effect of Gln and NAG on cell viability in H2O2-treated HaCaT.
(A) HaCaT cell viability was decreased with increasing H2O2 concentration (60, 80, 100, 200, 400, 600, 800 μM). (B) The effect of Gln and NAG on cell viability in 100 μM H2O2-treated HaCaT was measured by the WST-1 assay. Cell viability by Gln and NAG was increased in a dose dependent manner in H2O2-treated HaCaT. The graph represents the M±S.D. of the relative cell viability in each sample from triplicate experiments. The student's t-test was conducted to determine statistical significance (**p<0.01, ***p<0.001). Gln, glutamine; NAG, acetyl glutamine; WST, water-soluble tetrazolium salt; M±S.D., mean±standard deviation.
3. 세포 노화 억제효과
Gln과 NAG가 세포 노화에 미치는 영향을 확인하기 위하여 SA-β-galactosidase assay를 실시하였다. HaCaT에 Gln, NAG 만을 20 mM의 농도로 처리할 경우, 노화된 세포의 비율은 무처리군과 차이가 없었으므로 Gln, NAG은 세포 노화에 영향을 미치지 않음을 추측할 수 있다. 100 μM의 H2O2를 처리했을 경우, 노화된 세포 비율이 60%로 증가하여 H2O2가 HaCaT의 노화를 촉진하는 것을 알 수 있었다. 노화된 세포 비율은 Gln 20 mM 전처리 시 36%, NAG 20 mM 전처리 시 28%로 감소하여 두 시료 모두 세포 노화를 억제하였다(Figure 3). 그러나 NAG에서 더 높은 감소율을 보였기 때문에 NAG가 H2O2로 인한 세포 노화로부터 HaCaT를 더 효과적으로 보호함을 알 수 있다.

The effect of Gln and NAG on senescence in H2O2-induced HaCaT.
H2O2-induced HaCaT were treated with Gln 20 mM and NAG 20 mM. And then cellular senescence level was measured by using a senescence associated β-galactosidase assay. The results are presented as M±S.D. of three independent experiments. The student's t-test was conducted to determine statistical significance (***p<0.001). Gln, glutamine; NAG, acetyl glutamine; M±S.D., mean±standard deviation.
4. p53 활성 억제
Gln과 NAG 처리에 의한 p53의 활성 변화를 확인하기 위하여 western blotting을 실시하였다. HaCaT에 100 μM H2O2 만을 처리하면 p53의 양이 무처리군에 비하여 급격하게 증가하지만, Gln 20 mM, NAG 20 mM을 각각 전처리 시 감소함을 확인하였다. p21의 경우 무처리군에서는 거의 발현이 되지 않으나 H2O2 처리 시 급격하게 단백질양이 증가하고, Gln과 NAG 처리 시 감소함을 보였다. 특히, NAG 20 mM 처리 시 무처리군과 유사한 수준으로 감소하여 NAG가 세포 노화를 억제함을 알 수 있다(Figure 4).
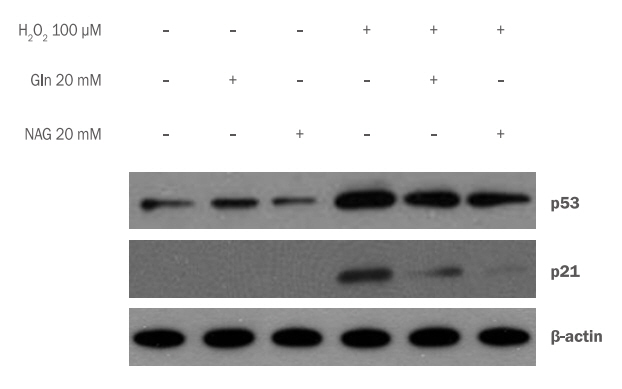
Inhibition of p53 accumulation by Gln and NAG in H2O2-induced HaCaT.
Western blotting was performed to confirm the change of p53 activity by Gln and NAG treatment. P53 accumulation by 20 mM Gln and 20 mM NAG In 100 μM H2O2-induced HaCaT was decreased. In p53 accumulation, 20 mM NAG treatment decreased more than 20 mM Gln treatment. Gln, glutamine; NAG, acetyl glutamine; M±S.D., mean±standard deviation.
5. 각질형성세포 분화 조절
Gln과 NAG가 HaCaT 분화에 영향을 주는지 확인하기 위해 HaCaT에 Gln, NAG를 처리하고 involucrin과 keratin1의 단백질 변화를 western blotting analysis로 확인하였다. 2 mM CaCl2를 처리하여 HaCaT의 분화를 유도한 결과 7일부터 involucrin과 keratin 1의 양이 증가하기 시작하고 9일에는 발현이 급격하게 증가하여 분화가 되었음을 알 수 있었다(Figure 5A). Gln과 NAG가 분화 조절에 미치는 영향을 확인하기 위하여 7일 조건에서 실험을 진행하였다. HaCaT에 2 mM CaCl2와 Gln 20 mM, NAG 20 mM을 처리 후 단백질 변화를 관찰한 결과 Gln, NAG 모두 CaCl2 단독 처리군에 비하여 involucrin과 keratin 1의 발현이 증가함을 확인하였다. 특히, NAG 20 mM 처리군에서는 Gln 20 mM 처리군보다 keratin 1과 involucrin의 발현이 현저하게 증가함을 확인하여 NAG가 각질형성세포의 분화를 촉진하는 효능이 더 우수함을 확인하였다(Figure 5B). 이러한 결과는 NAG가 각질형성세포의 분화 초기와 후기의 신호전달계 활성화에 영향을 준 것으로 추측할 수 있다.
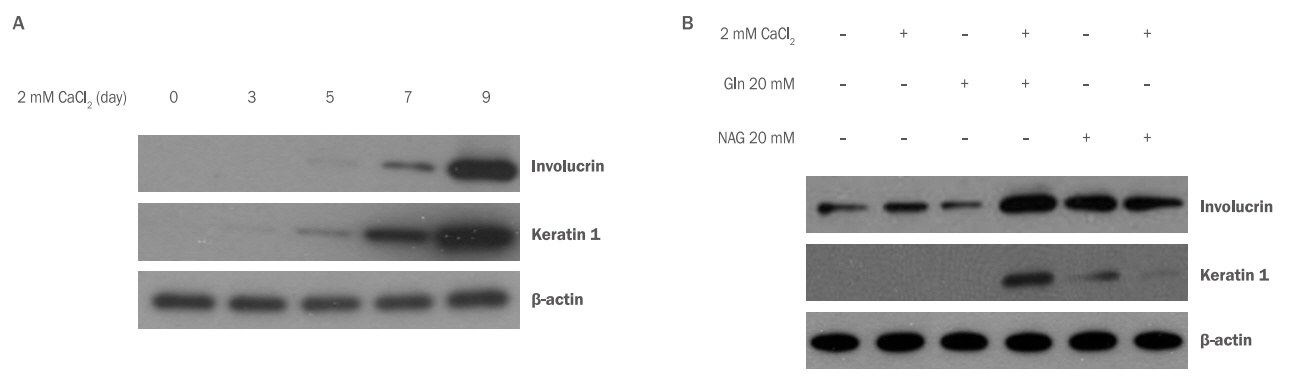
The effect of Gln and NAG on differentiation in HaCaT.
To investigate the effect of Gln and NAG on HaCaT differentiation, the changes of involucrin and keratin 1 were confirmed by Western blotting analysis. (A) The expressions of involucrin and keratin 1 were increased from 7 days after treatment with 2 mM CaCl2 to induce differentiation of HaCaT. (B) Both Gln and NAG showed increased the expression of involucrin and keratin 1 compared to CaCl2 alone. NAG at 20 mM increased expressions of keratin 1 and involucrin remarkably more than Gln. Gln, glutamine; NAG, acetyl glutamine.
6. 인간 진피섬유아세포에 대한 독성
HDFs에 농도별로 Gln, NAG을 처리하여 세포 독성을 확인한 결과 HaCaT과 마찬가지로 두 시료 모두 독성이 없었으며(Figure 6A,6B), NAG 처리에 의한 생존율이 더 높게 나타났다(Figure 6B).
Cytotoxicity of Gln and NAG on HDFs.
Cell viability of Gln (A) and NAG (B) on HDFs (3×103) was measured by the WST-1 assay. (A) Gln was non-toxic to HDFs at the 0.002, 0.02, 0.2, 2, 20, and 200 mM concentrations. (B) NAG was non-toxic to HDFs at the 0.002, 0.02, 0.2, 2, 20, and 200 mM concentrations. Gln, glutamine; NAG, acetyl glutamine; WST, water-soluble tetrazolium salt; M±S.D., mean±standard deviation.
7. 인간 진피섬유아세포 보호효과
HDFs에 H2O2를 처리했을 때 H2O2의 농도가 높아질수록 세포생존율이 감소하였다. 200 μM의 농도에서 약 80%의 생존율을 보였고 그 이상의 농도에서는 생존율이 70% 미만으로 나타나 HDFs에 대한 H2O2 처리 농도는 200 μM로 설정하였다(Figure 7A). Gln과 NAG의 H2O2에 대한 HDFs 보호효과를 알아보기 위해 HDFs에 200 μM의 H2O2를 처리하고 Gln, NAG를 각각 2, 20, 200 mM의 농도로 전 처리하여 생존율의 변화를 확인하였다. Gln 2 mM은 85%, 20 mM은 91%, 200 mM은 95%의 생존율을 보였으며, NAG 2 mM은 91%, 20 mM은 98%, 200 mM은 99%의 생존율을 보였다(Figure 7B). 이를 통해 HDFs에서도 역시 NAG가 H2O2에 의해서 저하된 세포 생존율을 더욱 효과적으로 증가시킴을 알 수 있다.

The effect of Gln and NAG on cell viability in H2O2-treated HDFs.
(A) Cell viability was decreased with increasing H2O2 concentration (100, 200, 400, 600, 800, 1000 μM). (B) The effect of Gln and NAG on cell viability in 200 μM H2O2-treated HDFs was measured by the WST-1 assay. Cell viability by Gln and NAG was increased in a dose dependent manner in 200 μM H2O2-treated HDFs. The graph represents the M±S.D. of the relative cell viability in each sample from triplicate experiments. The student's t-test was conducted to determine statistical significance (*p<0.05, **p<0.01). Gln, glutamine; NAG, acetyl glutamine; WST, water-soluble tetrazolium salt; M±S.D., mean±standard deviation.
8. MMP1 유전자 발현억제 및 COL1A1 유전자 발현촉진
HDFs에 H2O2에 의한 산화적 스트레스가 발생하면 콜라겐 분해 효소인 MMP1의 발현은 증가하고, 콜라겐의 생성은 감소한다. 그로인해 진피층의 탄력이 감소되고, 주름이 생성된다(Kim & Yoon, 2013). Gln과 NAG가 MMP1 mRNA 및 COL1A1 mRNA 발현에 미치는 영향을 확인하기 위해 qRT-PCR을 실시하였다. 그 결과, MMP1 mRNA의 발현은 H2O2 200 μM 처리 시 무처리군에 비해 4.3배 증가하였으며, Gln 20 mM 전처리 시 2.7배, NAG 20 mM 전처리 시 2.3배로 발현이 감소하여 NAG가 MMP1 mRNA 발현을 감소시켰다(Figure 8A). HDFs에 H2O2를 처리하면 피부 콜라겐 유전자인 COL1A1 의 발현은 0.7배 감소하였다. 그러나 Gln과 NAG를 각각 20 mM 전처리하면 COL1A1 의 발현이 증가하였으며, NAG 전처리 시 발현이 더 증가함을 확인하였다(Figure 8B). 이러한 결과를 통해 NAG는 COL1A1 유전자의 발현을 촉진하고, MMP1 유전자의 발현을 저해함으로써 피부 탄력과 주름을 개선시키는 효력이 있음을 추측할 수 있다.
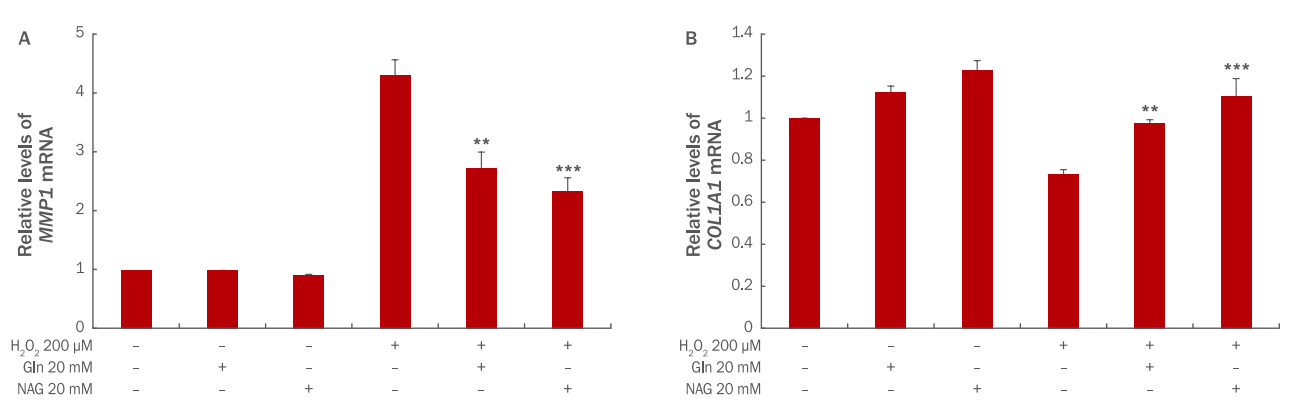
The effect of Gln and NAG on MMP1 mRNA (A) and COL1A1 mRNA (B) expression in H2O2-treated HDFs.
(A) The expression of MMP1 mRNA was increased 4.3 folds at 200 μM H2O2-treated HDFs, and was decreased 2.7 folds in the case of Gln 20 mM treatment and 2.3 folds in the case of NAC 20 mM treatment. (B) The expression of COL1A1 mRNA was decreased 0.7 folds at 200 μM H2O2-treated HDFs, and was increased 0.9 folds in the case of Gln 20 mM treatment and 1 folds in the case of NAC 20 mM treatment. The results are presented as M±S.D. of three independent experiments. The student‘s t-test was conducted to determine statistical significance (**p<0.01, ***p<0.001). MMP1, matrix metallopeptidase 1; COL1A1, collagen, type I, alpha 1; Gln, glutamine; NAG, acetyl glutamine; M±S.D., mean±standard deviation.
Conclusion
본 연구에서는 산화적 스트레스가 유도된 인간 피부세포에서 아세틸글루타민의 노화억제 및 각질형성세포 분화조절로 인한 피부장벽을 강화시키는 보습제로서의 효능을 세포효력시험을 통해 검증하였다.
첫째, 아세틸글루타민은 피부세포의 노화를 억제한다. 아세틸글루타민은 H2O2에 의해 증가하였던 노화된 세포의 비율과 p53과 p21의 발현을 감소시켜 HaCaT에서 H2O2에 의해 유도되는 노화를 효과적으로 억제하였다. 또한 HDFs에서 MMP1 유전자의 발현을 감소시켰고, type I collagen의 유전자인 COL1A1 유전자의 발현은 증가시켜 H2O2에 의한 산화적 스트레스로부터 진피층의 결합조직이 손상되는 것을 효과적으로 억제했다.
둘째, 아세틸글루타민은 피부장벽 기능을 강화한다. 아세틸글루타민은 대표적인 분화 표지인자인 keratin 1과 involucrin의 발현을 증가시켜 각질형성세포의 분화를 촉진하는 효력이 글루타민보다 더 우수하였다. 이러한 결과는 아세틸글루타민이 각질형성세포의 분화 초기와 후기의 신호전달계 활성화에 영향을 준 것으로 추측할 수 있다.
이상과 같은 결과는 아세틸글루타민이 효과적인 노화 억제 물질로서 항노화와 주름 개선, 보습제로서의 피부장벽 기능 강화, 피부상태 개선 효능을 확인한 것으로 화장품 원료로써의 충분한 가치를 보여주는 것이라 할 수 있다.
Notes
This work is a part of Hyun Hee Jang’s Ph.D. thesis at the Konkuk University, Seoul, Korea.