Introduction
Individual typology angle(ITA)值是基于CIE L*a*b*颜色空间建立的皮肤颜色测量指标。ITA值可由三个参数L*,a*,b*以固定公式表示,L*、a*、b*分别表征亮度、红绿色相、黄蓝色相,对应可评价皮肤发黑、发红、发黄的情况,此三种情况也是影响肤色美观的主要方面。ITA值能够将皮肤颜色的考察量化,且具有多角度、较全面、低成本、易测量、测量原理清晰和数据客观等特点。本文以构成ITA值的亮白、红-绿色相、黄-蓝色相三个因素为分类依据,对导致皮肤发黑暗沉、发红、发黄的影响因素进行了梳理分析,总结了部分因素的生化机制及通路交叉点,依此提出一些改善皮肤颜色的建议及“以点带面”的护肤设想。
Application of ITA in complexion measurement
皮肤颜色的测量可分为主观测量法和客观测量法。正常皮肤的肤色变化是色泽的微小改变,对皮肤颜色分析的要求较高。借助各种分析仪器进行数字图像分析的客观测量法,结果较主观的视觉分析更为准确可靠,重复性好,能获得精确的数据,因此主要应用于化妆品领域的有效性验证或是对精确性要求较高的临床疗效研究。ITA值测量依托反射光谱分析技术,应用于皮肤颜色测量已有50多年的积累,其参数已与人类皮肤色素沉着相关皮肤病学研究公认工具Fitzpatrick’肤色分级量表建立了量化的分级标准,广泛应用于皮肤颜色研究和化妆品功效评测中。
1.The formation of skin color
颜色来源于眼睛对光的视觉感受,同时具有色相、明度、饱和度三个特性。不同波长的电磁波表现出不同的颜色,光源的光谱组成和物体表面反射、折射的各波长光的比例决定了人眼感受到的物体颜色。对皮肤颜色起到决定作用的主要因素有黑色素、血红蛋白、真皮血管及真皮纤维等,表皮中的透明角质颗粒和真皮中的胶原纤维束充当主要的反射物质。角质层的状态也极大的影响着皮肤对光线的反射:光滑的、润泽的角质层有规则的反射出明亮的光泽,干燥粗糙的角质层则已非镜面的方式反射光线,显现出灰暗的皮肤状态。皮肤颜色也受到外部因素的影响,测量的部位、身体姿势、温度探头的压力以及使用的外用制剂都会产生一定影响(Yue & Zhu, 2003)。体内的内分泌变化,如女性的月经、妊娠等引起的雌激素水平波动也会对表皮厚度和新的胶原生成产生促进作用进而影响皮肤颜色(Song & Lai, 2008)。此外,一些疾病和食物药物的摄入也会造成皮肤颜色的改变。
2. Application of ITA value in complexion measurement
1) Establishment and composition of ITA
ITA值是对个人皮肤颜色的测量分级指标,建立在皮肤美容常用的CIE L*a*b*颜色空间的基础上,通过三刺激值色度计进行测量。用光度计测量皮肤对每一波长光的反射率,从而获得被测颜色表面的分光光度曲线。L*、a*、b*数值分别构成一个三维坐标空间的垂直轴和水平轴,L*值代表颜色的黑白亮度,b*值用于测量发黄情况,a*值则很好地表达皮肤红斑或发红程度。ITA计算公式建立在其基础上:ITA=ArcTangent[(L*-50)/b*]×180×3.1416
简而言之,上述四个指标分别代表了皮肤颜色发黑、发红、发黄的程度及其综合情况。
2) Classification and application of ITA
皮肤是由表皮层、真皮层和皮下组织构成,其颜色测量与其它材料(例如:油漆,金属,布匹等)上的颜色测量完全不同,环境光以及测量装置发出的光线穿透皮肤到不同的深度,会以不同的方式被吸收和反射。因此在使ITA值进行考量时,是分别进行考察的:探头发出白色LED灯,圆形排列均匀地照亮皮肤。发射的光在各个方向散射,有些部分穿过各个层,有些部分散布在皮肤外面,从皮肤反射的光被探针回收并相应地表达为L*、a*、b*值。同时,仪器会使用特殊颜色矩阵校正探针的原始数据,从而尽可能接近标准值,使得测量所得的数据更加的准确。
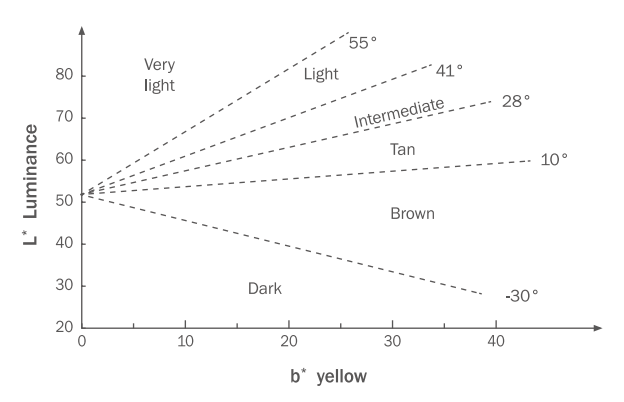
通过多年的实验和实践,于1976年建立了基于ITA值的 Fitzpatrick’肤色分级标准,对肤色的分级如Figure 1所示。ITA值将亮度和色相两方面因素进行了结合,可从三个维度立体考量色泽,是一个较为全面的综合性指标,已建立分级标准,具有很好的可信度,经过几十年的应用已十分成熟。依据该标准,有研究对居住在中国的1082名亚洲女性(中国上海682名,广州400名)和日本464名亚洲女性,进行了ITA值采集和处理,得到东北亚的皮肤类型处于白,中等和棕褐色区域较多;生活在印度的158名亚裔女性和泰国58名亚洲女性的ITA值显示,南亚皮肤类型显示从浅肤色到黑皮肤组的色素沉着程度的多样性(Del Bino & Bernerd, 2013)。由此可见ITA值在亚洲人肤色量化分级的适用性。
依托于三刺激值色度计进行测量的ITA值已在国际国内得到广泛应用和认可,我国空军总医院皮肤科、四川华西医院皮肤科等已大面积采用该方法进行研究。程英、王学民等人在2005年对三刺激值色度计和窄谱反射分光光度计进行了对照实验,验证了本仪器和方法重复性高、敏感性好,在体外及人体都有显著相关性的良好性能(Cheng et al., 2005)。李艳、李利等人应用ITA值考评了200名志愿者的皮肤颜色和部位、年龄及性别的相关性(Li et al., 2005)。此外,欧莱雅、安利等国际著名企业也在中国境内资助开展了应用ITA考评中国人皮肤颜色的实验,或以ITA值为基本,验证新图像法与L*、a*、b*、ITA值的相关性关系(Yuan et al., 2012)。
由上可见以ITA值为指标考量皮肤颜色,操作简便、准确性可重复性好,业已建立分级标准,是皮肤色泽测量中的常用手段。目前对于ITA值的研究主要分为两个部分,绝大多数研究集中于延续常规方法测量不同人群的皮肤色泽数据,建立数学模型对其自身规律进行统计分析,或作为参照与其他仪器的指标建立相关性联系。另一方面,近年来有学者正在探索ITA与皮肤内色素或黑素细胞代谢过程中产生的物质的相关性关系,使得对ITA值和皮肤色泽的研究由皮肤的表观拓展到了表观与内源相结合的层面。
Main influencing factors of ITA
ITA值的三个参数分别表征皮肤发黑、发红、发黄的情况,这也是影响大众肤色美观问题的主要方面。经调研分析,将基于ITA的皮肤颜色影响因素及其相关性关系总结如 Figure 2所示。
1. Main influencing factors of L*
1) Melanin
黑色素是皮肤颜色的主要来源之一,对表征明亮度、黑白的L*值有着极其重要的影响。有研究表明,表皮黑色素含量似乎是人类皮肤中L*值的主要决定因素,而黑素小体的大小对L*值也具有显著的影响(Alaluf et al., 2012)。真黑素呈现黑色,少量时呈现灰色;褐黑素,呈现棕色(Ye & Zhu, 2016)。在黑素代谢方面,Bino 和 F. Bernerd分析了黑素细胞UVR诱导的DNA损伤,发现ITA和生物有效剂量(biologically efficient dose,BED)之间存在显着的相关性(Del Bino & Bernerd, 2013)。2015年该团队又发现ITA值与黑素的含量及分布呈负相关,与黑素降解产物如DHICA黑色素降解产物(degradation product of DHICA melanin, PTCA)、苯并噻唑型黑素的降解产物(degradation product of benzothiazole-type pheomelanin, TTCA)的含量及分布呈负相关。即ITA值越低,黑素含量越多、分布越广泛,降解产物PTCA、TTCA含量越高(Del Bino et al., 2015)。
2) Sebum and moisture
具有砖墙结构的表皮角质层,由脂质填充在角质化的细胞间,形成致密平滑的皮肤屏障。光滑平整的、含水较多的角质层能够有规则地反射,从而形成明亮的光泽,而干燥则少油有鳞屑的角质层以非镜面反射的方式反射光线,使皮肤无光晦暗。另一方面,人的皮脂构成中约含有10%的角鲨烯,其性质活泼易被氧化。空气中的氧气、紫外线辐射、环境中痕量的金属都可催化角鲨烯的氧化反应,因此在皮脂通过清洁等手段从皮肤表面去除之前,大量的角鲨烯氧化产物就驻留于皮肤表面,角鲨烯老化形成黄色的极性化合物(Yu et al., 2016)。即皮脂堆积时会发黄,使得L*、b*值升高。
2. Main influencing factors of a*
1) Oxyhemoglobin
在真皮血管中存在着血红蛋白,血红蛋白本身呈蓝色,氧合血红蛋白呈红色。皮下血管中的血流量、红细胞的数量、氧合血红蛋白和血红蛋白的相对比例的不同使皮肤在代表红-绿色相的a*值产生差异。在角质层较薄或没有角质层的部位,氧合血红蛋白的红色会更明显,而在黑素较多的皮肤,红色的氧合血红蛋白和蓝红色的血红蛋白对皮肤的颜色影响就很小了(Yue & Zhu, 2003)。
2) Microcirculation
人体面部肤色在微循环舒畅的情况下会表现红润的健康状态,血量不足与血流不畅都将导致面色晦暗及色素沉着的情况发生。较好的血液循环为肌肤的成纤维细胞、胶原蛋白等提供充足的氧分和营养,将细胞的代谢产物和各种有害物质及时清除,保证皮肤的正常新陈代谢,使面色透白红润。已有实验研究表明,血液动力学指标血流灌注量能影响皮肤的经皮失水率(transepidermal water loss, TEWL)从而影响皮肤屏障(Rodrigues et al., 2004)。而当皮肤微循环速度加快时,单位时间内通过的红细胞数量增多,红色的氧化血红蛋白也随之增多,自然显现出白皙红润的肤色。
另一方面来说,微循环造成的a*值的提高并不都是有利于皮肤健康的。首先,当面部角质层较薄时,皮肤的颜色更加容易显现,很多面部皮肤病的共同症状之一都是面部潮红及毛细血管扩张血流量增加(潮红),后期血管会出现病理性的扩张和增粗。而痤疮、丘疹、皮肤敏感的面部皮肤问题发生时,均会产生局部的炎症反应和毛细血管增生,造成局部发红的情况。以上情况临床已有成体系的治疗手段,能够有效消除扩张的毛细血管,刺激萎缩等的真皮结缔组织重塑,强化表皮屏障,从而改善皮肤潮红和红斑的症状。
3. Main influencing factors of b*
b*值在CIE L*a*b*颜色空间中表征黄-蓝色相,主要反映皮肤的暗黄程度,b*值越高,肤色越黄。对肤色发黄的形成除却遗传因素外,主要来自于衰老过程中高级糖基化终末产物AGEs的堆积和脂褐素的累积,另外还有一些色素及发色基团等的影响。
1) Advanced glycation end products
Dyer等人发现胶原蛋白和弹性蛋白分子中的氨基酸容易与细胞外液中葡萄糖发生非酶糖基化反应,反应生成高级糖基化终末产物(advanced glycation end-products, AGEs),且高级糖基化终末产物AGEs随年龄的增长进行性增加(Dyer et al., 1993)。AGEs发生褐变后会形成棕黄色的生物垃圾,在真皮层堆积,进而导致皮肤泛黄、暗沉,皮肤视觉效果的剔透感下降(Lai et al., 2009)。胶原蛋白和弹性蛋白的非酶糖基化过程中,皮肤的弹性和通透性降低,使养料及废物的扩散性能减弱,而且降低了胶原的可溶性使其难以被胶原酶水解,造成皮肤弹性下降,皱纹不易平复且不断加深,对光线的折射反射散射作用发生变化,使皮肤粗糙暗沉(Lai et al., 2009)。皮肤中的AGEs会发出一种波长在330-500 nm的特征性荧光,已有研究应用无创性仪器对皮肤中的此类物质进行量化及其与肤色相关性的研究(Koetsier et al., 2010)。非酶糖基化反应过程中产生一些活性羰基化合物会参与羰基氧化应激反应,产生脂褐素导致肤色暗黄。
2) Lipofuscin
脂褐素(lipofuscin)又称老年素,是沉积在组织衰老细胞中的黄褐色不规则小体,在普通显微镜下观察大小约0.1-5 μm的棕色颗粒有淡黄乃至橙红色的自发荧光,其大小和形态随着年龄及所在器官而异。目前已有多种学说对其产生进行阐释,本文主要从自由基衰老学说和羰基毒化作用进行分析。过量的自由基将不饱和脂肪酸氧化成过氧化脂质,其终产物丙二醛有很强的交联性质,它与含游离的氨基的磷脂、蛋白质、核酸等生物大分子交联,形成难溶的具有荧光性的 Schiff碱(RN=CH-CH=NHR),即脂褐素。脂褐素难溶于水,不易被代谢排出,因此随着年龄的增大,脂褐素在细胞内含量增加且有密集和增大的趋势,使得皮肤愈加暗黄(Lai et al., 2009)。非酶糖基化、脂质过氧化和氨基酸代谢及其他一些反应过程中产生的活性羰基化化合物,与蛋白质氨基酸残基的羰-氨的交联反应,会诱导多聚或交联的脂褐素,造成真皮脂褐素的累积,使皮肤发黄、暗沉,色素聚集后还会产生老年斑、黄褐斑等问题(Gu et al., 2011)。另外,许多α, β-不饱和醛酮与核苷酸反应也会形成老年色素类生化聚合物,导致皮肤发黄。
3) Other factor
血红蛋白在未氧合状态下呈蓝色,会将表征黄-蓝色相的b*值拉低。胆黄素呈黄色,类胡萝卜素成橘黄色,褐黑素呈棕色。其他一些发色团包括核昔酸的嘌呤和嘧啶碱基、氨基酸如苯丙氨酸、酪氨酸、色氨酸和半胱氨酸以及卟啉、核黄素和类固醇等这些物质的比例和量对皮肤的颜色状态也会产生影响(Yue & Zhu, 2003)。这些色素都对表征蓝-黄色相的b*值有或多或少的影响,但其为机体生命活动不可或缺的重要物质,且从皮肤结构而言分布较深,故不多加讨论。
Assumption of ITA improvement
通过对皮肤发黑、发红、发黄影响因素的总结,我们认为对皮肤色泽的改善主要可以从对黑色素的合成代谢调控、微循环的改善以及清除自由基抗氧化三个方面进行。黑色素是影响L*值最重要的因素,黑素细胞生成黑素小体后,逐渐上移至角质形成细胞,最后从角质层排出,因此调节色素的合成代谢对改善肤色发黑至关重要。目前已有的美白剂作用机制主要有:酪氨酸酶mRNA转录抑制、酪氨酸酶糖基化的调节和其降解的催化或加速、α-黑素细胞刺激激素(α-melanocyte-stimulating hormone, α-MSH)/环状腺苷单磷酸(cyclic adenosine monophosphate,cAMP)依赖性信号通路抑制、 mitogen-activated protein kinases(MAPK)信号通路调节、Wnt信号通路调节、niric oxide(NO)信号通路抑制、微小珠蛋白相关转录因子(microphthalmia-associated transcription factor, MITF)的调节或抑制、黑素体的形成和转移调节、P-type copper transporting adenosine triphosphatase(ATP7A)运输抑制、下调黑皮质素1受体(melanocortin 1 receptor, MC1R)活性、表皮角化细胞中黑色素降解调节等(Burger et al., 2016)。调节皮肤黑色素沉着有着多向的方法,无论是化学还是酶催化都可以被抑制,也已有多种方法来探寻抑制酪氨酸酶的催化活性并破坏黑色素的合成和释放的化学物质。虽然酪氨酸酶抑制剂仍是最广泛使用的美白剂,但作用于上游各通路或下游分解代谢的物质也在广泛的开发应用中。
改善皮肤的微循环可以为皮肤的成纤维细胞、角质形成细胞等提供充足的氧份和营养,将细胞的代谢产物和各种有害物质如自由基等及时清除。L*方面,黑素合成过程中必需的氧的供给受到抑制,加速了皮肤黑素代谢使其下移至毛细血管并随血液循环排出。a*值和b*值方面,皮肤微循环速度加快,肤色自然白皙红润,同时使得胶原蛋白和弹性蛋白的羰基毒化受损减少。因此,改善微循环可以高效影响ITA值的表现。
抗氧化、清除自由基对影响肤色美观的发黑发红发黄都有显著作用,是改善肤色的重要方法。L*方面,氧化是黑素合成的关键,黑素合成过成中多巴反应生成多巴醌、多巴醌反应生成多巴色素等多个关键步骤实际都为氧化反应。Reactive oxygen species(ROS)诱导皮表氧化会导致屏障功能受损,增大皮肤粗糙度影响光线反射。皮肤发黄方面,ultraviolet(UV)辐射下调胶原蛋白和弹性纤维的合成,上调了ROS和过氧化氢,下调了抗氧化酶。˙OH和1O2氧化脂质的不饱和键,产生脂质过氧化物和醛,与蛋白质中的氨基酸残基发生反应,即自由基导致的脂褐素生成(Masaki, 2010)。综上可知抗氧化清除自由基对改善皮肤亮度和祛黄都会发挥很好的效果。
Conclusion
通过总结,我们可以发现许多同时对多方向具有调节作用的因子。例如NO作为内皮依赖性舒张因子,一方面对于维持正常气血微循环起着至关重要的作用,间接促进黑素代谢产物的排出;另一方面,外源性微循环调节因NO还能影响成纤维细胞I型胶原的分泌。酪氨酸酶的转录调控及相关信号通路之一中,调节血管功能的重要因子内皮素(endothelin, ET)与内皮素受体B基因(endothelin receptor type B, EDNRB)特异性结合可激活Ras/Raf信号通路(Ye & Zhu, 2016),这是另一黑素和微循环的交叉点。又如活性氧ROS激活表皮苯丙氨酸加氢酶促进黑素,也会导致脂褐素的生成累积(Masaki, 2010)。已有研究表明黑色素是较亮白皮肤类型中b*值的主要来源之一(r=0.71,p <0.00001),但由于表皮中高浓度的黑色素对黄光存在光学掩蔽作用,这种关系随着皮肤中黑色素浓度的增加而降低(Alaluf et al., 2012)。
AGEs作为导致皮肤暗黄的主要因素之一,临床上胶原交联形成的AGEs的累积与动脉硬化和微血管疾病有着密切的关系,即对微循环造成负面影响,在导致肤色暗黄的同时降低了红润感和代谢废物转运能力。有研究表明AGEs具有促进ROS 生成,抑制超氧化歧化酶活性,降低NO生物利用度的作用(Franke et al., 2009),因此对微循环和黑色素生成都存在间接影响。表皮中AGEs通过上调FAs和ELOVL上调游离脂肪酸含量,尤其是饱和脂肪酸含量显著增加打破皮脂正常比例,造成皮肤屏障的破坏(Yokota & Tokudome, 2016),对皮肤亮度产生负面影响。
由上可见,多个作用方向具有交叉点,由此我们得到启发:是否能够寻找到更多的关键路径的分子层面交点,进而找到高效作用于交叉点的功效物质,使得皮肤护理能够以一当十,达到少量高效、以点带面改善肤色的效果。
本文总结了影响ITA值的因素及部分通路交叉点,并依此提出了改善皮肤发黑暗沉、发红、发黄的的建议及“以点带面”的护肤设想。ITA值作为一个皮肤颜色考量指标,计算及矫正公式已得到多年的验证、实践和广泛的应用,重复性高、敏感性好、可靠性高,亚洲地区已有诸多研究依此进行人群的肤色分级。它将明亮度L值与色相a值,b值进行了有机结合,使对肤色的考评不止步于单一的颜色测定,而是“色”“泽”兼备,全面且更符合使用者的心理需求。近年来对ITA值及L*a*b*的研究,逐步拓展到与皮肤内色素或黑素代谢物质的相关性关系研究,使其对皮肤色泽的衡量更加深入可靠,有据可循。更加重视其在肤色发黑发黄发红细分类方面的应用意义,进一步探索ITA并拓展其应用范围,研究不同人群皮肤色泽差异,开发综合提升皮肤的色与泽的化妆品,在高度成熟的美白市场上或许大有可为。