Andersen HR, Nielsen JB, Nielsen F, Grandjean P. Antioxidative enzyme activities in human erythrocytes.
Clinical Chemistry 43: 562-568. 1997.

Arnao MB, Cano A, Acosta M. The hydrophilic and lipophilic contribution to total antioxidant activity.
Food Chemistry 73: 239-244. 2001.

Cha JY, Kim HJ, Chung CH, Cho YS. Antioxidative activities and contents of polyphenolic compound of Cudrania tricuspidata. Journal of the Korean Society of Food Science and Nutrition 28: 1310-1315. 1999.
Cha JY, Kim HJ, Cho YS. Effects of water-soluble extract from leaves of Morus alba and Cudrania tricuspidata on the lipid peroxidation in tissues of rats. Journal of the Korean Society of Food Science and Nutrition 29: 531-536. 2000.
Cho EJ, Yokozawa T, Rhyu DY, Kim SC, Shibahara N, Park JC. Study on the inhibitory effects of Korean medicinal plants and their main compounds on the 1,1-diphenyl-2-picrylhydrazyl radical.
Phytomedicine 10: 544-551. 2003.


Choi SR, You DH, Kim JY, Park CB, Kim DH, Ryu J. Antioxidant activity of methanol extracts from Cudrania tricuspidata Bureau according to harvesting parts and time. Korean Journal of Medicinal Crop Science 17: 115-120. 2009.
Chon IJ, Lee SW, Cha JH, Han JH, Whang WK. Anti-oxidant compounds of Cudrania tricuspidata leaves. Yakhak Hoeji 49: 416-421. 2005.
Fisher GJ, Talwar HS, Lin J, Voorhees JJ. Molecular mechanisms of photoaging in human skin
in vivo and their prevention by all-trans retinoic acid.
Photochemistry and Photobiology 69: 154-157. 1999.


Jeong HJ, Lee SG, Lee EJ, Park WD, Kim JB, Kim HJ. Antioxidant activity and anti-hyperglycemic activity of medicinal herbal extracts according to extraction methods. Korean Journal of Food Science and Technology 42: 571-577. 2010.
Jeong KS, Kim JD. A study on future trends of cosmetic industrial development: cosmeceuticals. The Journal of Skin Barrier Research 1: 35-40. 1999.
Joo HY, Lim KT. Protective effect of glycoprotein isolated from Cudrania tricuspidata on liver in CCl4-treated A/J mice. Korean Journal of Food Science and Technology 41: 93-99. 2009.
Jung TH. Illustrated encyclopedia the fauna and flora of Korea: tracheophyta. Ministry of Education. Sejong. pp1475. 1965.
Kang DG, Hur TY, Lee GM, Oh H, Kwon TO, Sohn EJ, Lee HS. Effects of
Cudrania tricuspidata water extract on blood pressure and renal functions in NO-dependent hypertension.
Life Sciences 70: 2599-2609. 2002.


Kim HJ, Cha JY, Choi ML, Cho YS. Antioxidative activities by water-soluble extracts of Morus alba and Cudrania tricuspidata. Applied Biological Chemistry 43: 148-152. 2000.
Kim JY, Chung JH, Hwang I, Kwan YS, Chai JK, Lee KH, Han TH, Moon JH. Quantification of quercetin and kaempferol contents in different parts of Cudrania tricuspidata and their processed foods. Korean Journal of Horticultural Science & Technology 27: 489-496. 2009.
Kim MJ, Jung TK, Yoon KS. Anti-aging effects of prescription extracts containing
Forsythia viridissima L.
Journal of the Society of Cosmetic Scientists of Korea 41: 85-96. 2015.

Kim MK, Kim JS, Jo BS, Kim JH, Lee IC, Lee MS, Cho YJ. Functional properties of walnut in cosmetics.
Journal of Life Science 21: 858-864. 2011.

Kim SE, Kim YH, Lee JT. Antioxidant activity and whitening efficacy of ethanolic extract of herb complex (
Oenothera laciniata, Phellinus linteus and
Glycyrrhiza uralensis Fischer).
Journal of Investigative Cosmetology 10: 27-33. 2014.

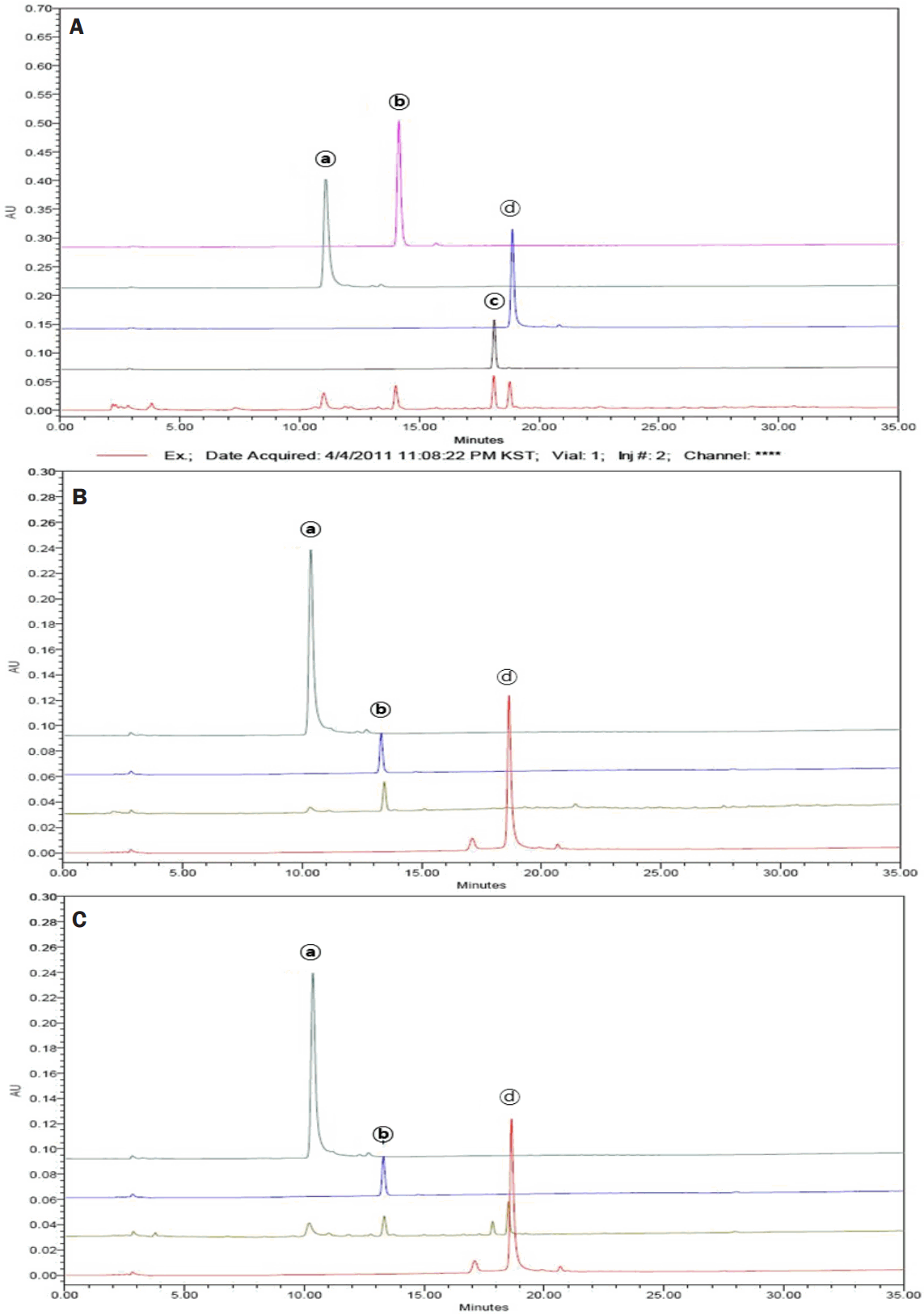
Kim SH, Kim NJ, Choi JS, Park JC. Determination of flavonoid by HPLC and biological activities from the leaves of Cudrania tricuspidata Bureau. Journal of the Korean Society of Food Science and Nutrition 22: 68-72. 1993.
Lee BW, Gal SW, Park KM, Park KH. Cytotoxic xanthones from
Cudrania tricuspidata.
Journal of Natural Products 68: 456-458. 2005.


Lee IK, Song KS, Kim CJ, Kim HM, Oh GT, Yoo ID. Tumor cell growth inhibition and antioxydative activity of flavonoids from the stem bark of Cudrania tricuspidata. Applied Biological Chemistry 37: 105-109. 1994.
Lee IK, Kim CJ, Song KS, Kim HM, Koshino H, Uramoto M, Yoo ID. Cytotoxic benzyl dihydroflavonols from
Cudrania tricuspidata.
Phytochemistry 41: 213-216. 1996.


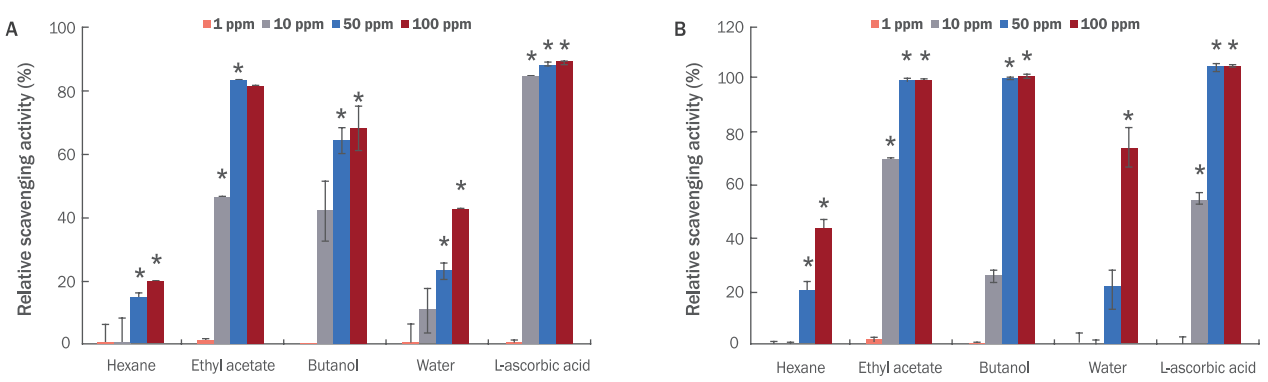
Lee JS, Han GC, Han GP, Kozukue N. The antioxidant activity and total polyphenol content of Cudrania tricuspidata. Journal of the East Asian Society of Dietary Life 17: 696-702. 2007.
Lee SK, Mbwambo ZH, Chung H, Luyengi L, Gamez EJ, Mehta RG, Kinghorn AD, Pezzuto JM. Evaluation of the antioxidant potential of natural products.
Combinatorial Chemistry & High Throughput Screening 1: 35-46. 1998.

Moure A, Cruz J, Franco D, Domínguez JM, Sineiro J, Domínguez H, Núñez MJ, Parajó JC. Natural antioxidants from residual sources.
Food Chemistry 72: 145-171. 2001.

Nam DE, Kim OK, Lee J. Therapeutic effects of
Curdrania tricuspidata leaf extract on osteoarthritis.
Journal of the Korean Society of Food Science and Nutrition 42: 697-704. 2013.

Nomura T, Hano Y, Fujimoto T. Three new isoprenylated xanthines, cudraxanthone A, B, and C, from the root barks of
Cudrania tricuspidata (Carr.) Bur.
Heterocycles 20: 213-218. 1983.

Omaye ST, Reddy KA, Cross CE. Effect of butylated hydroxytoluene and other antioxidants on mouse lung metabolism.
Journal of Toxicology and Environmental Health 3: 829-836. 1977.


Ottersen T, Vance B, Doorenbos NJ, Chang BL, el-Feraly FS. The crystal structure of cudranone, 2,6,3'-trihydroxy-4-methoxy-2'-(3-methyl-2-butenyl)-benzophenone: a new antimicrobial agent from
Cudrania cochinchinensis.
Acta Chemica Scandinavica Series B: Organic Chemistry and Biochemistry 31: 434-436. 1977.


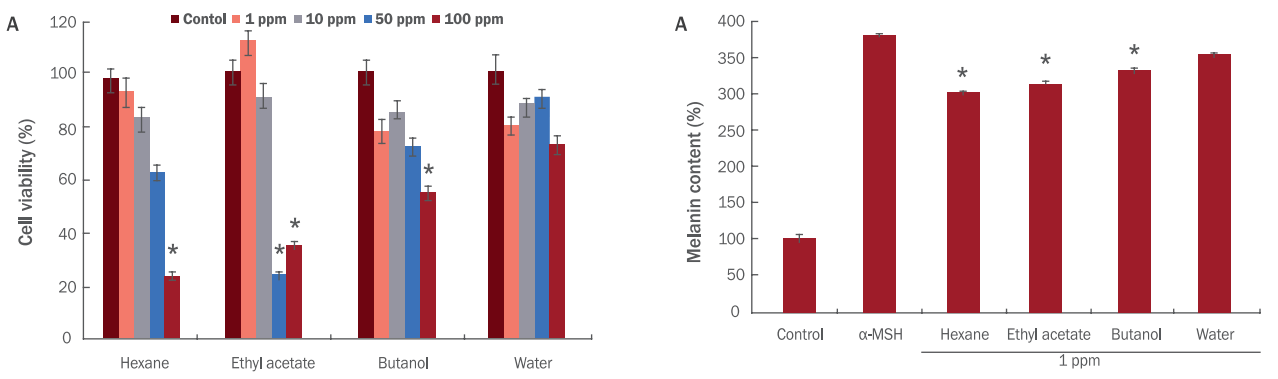
Park JC, Choi JS, Choi JW. Effects of the fractions from the leaves, fruits, stems and roots of Cudrania tricuspidata and flavonoids on lipid peroxidation. Korean Journal of Pharmacognosy 26: 377-384. 1995.
Ramarathnam N, Osawa T, Ochi H, Kawakishi S. The contribution of plant food antioxidants to human health.
Trends in Food Science & Technology 6: 75-82. 1995.

Seo SJ, Kong MR, Joo EY. Anti-aging and antioxidant activities of extracts from
Liriope platyphylla fruits.
Journal of Investigative Cosmetology 9: 105-114. 2013.

Shim JS, Kwon YY, Hwang JK. The effects of panduratin A isolated from Kaempferia pandurata on the expression of matrix metalloproteinase-1 and type-1 procollagen in human skin fibroblasts.
Planta Medica 74: 239-244. 2008.


Squadrito GL, Pryor WA. Oxidative chemistry of nitric oxide: the roles of superoxide, peroxynitrite, and carbon dioxide.
Free Radical Biology and Medicine 25: 392-403. 1998.


Zou YS, Hou AJ, Zhu GF, Chen YF, Sun HD, Zhao QS. Cytotoxic isoprenylated xanthones from
Cudrania tricuspidata.
Bioorganic & Medicinal Chemistry 15: 1947-1953. 2004.