요약방법독립변수는 온도(X1), 시간(X2)으로 설정하였고, 예비실험을 거쳐 각 요인의 최소 및 최대 범위를 온도 140-180℃, 시간 20-40 min으로 설정하였다. 종속변수는 total polyphenol 함량, total flavonoid 함량, DPPH radical 소거능, ABTS radical 소거능, α-glucosidase저해 활성으로 설정하여 측정하였다.
AbstractPurposeThis study was designed to optimize the conditions used for roasting freeze-dried silkworms for improving the quality using response surface methodology (RSM).
MethodsIndependent variables included temperature (X1; range 140°C–180°C) and time (X2; range 20–40 min) based on findings from preliminary experiments. Dependent variables included total polyphenol content, total flavonoid content, DPPH radical-scavenging activity, ABTS radical-scavenging activity and α-glucosidase inhibition activity.
ResultsWe identified the optimal conditions for roasting freeze-dried silkworms that included temperature (X1) and time (X2) of 180°C and 30 min, respectively. With these optimized variables, the total polyphenol content was 468.20 mg TAE/g, total flavonoid content was 294.62 mg QE/g, DPPH radical-scavenging ability was 72.07%, ABTS radical-scavenging activity was 71.81%, and α-glucosidase inhibition was 67.31%.
ConclusionOur results suggest that the biochemical properties of freeze-dried silkworms were improved by the roasting process using specific timing and temperature as indicated. We anticipate further interest in the use of roasted freeze-dried silkworms by the food industry and as a means to improve blood glucose levels.
Introduction최근 소득 수준의 향상과 식생활의 서구화 및 운동부족 등으로 당뇨병, 고혈압, 동맥경화증과 같은 만성질환이 증가되고 있다. 그 가운데 당뇨병의 증가가 뚜렷하여 사회적인 문제로 대두되고 있는 실정이다(Kang et al., 2017).
당뇨병은 완치가 어려운 만성질환으로 환자의 삶의 질을 저하시킬 뿐 아니라 의료비 부담이 높은 질병이다(De Groot et al ., 2001; Lee et al ., 2016). 그 동안 당뇨병의 치료는 대부분 혈당 강화제와 같은 약물치료에 의존하였으며(Cho & Choi, 2013), 그에 따른 부작용이 많았다. 이에 안전성이 확보된 천연물 소재인 뽕잎, 오디 및 누에 등의 양잠산물을 이용한 혈당개선 연구들이 활발히 진행되어왔다(Jang & Rhee, 2004).
특히, 누에는 혈당 강하작용(Cho et al ., 1998) 뿐만 아니라 간 기능 개선, 혈액순환, 항산화 작용 등의 다양한 효능이 보고되었다(Cha et al ., 2010). 누에에 다량 함유되어 있는 1-deoxynojirimycin (DNJ) 성분은 소장내 당분해효소인 α-glucosidase의 작용을 저해하여 식후 급격한 혈당 상승을 억제하여 인슐린 분비를 감소시키는 효과가 있다(Kim et al ., 2011; Kim et al ., 2018). 그러나 누에는 비릿한 맛(異味)과 역한 냄새(異臭)와 같은 결점과 외관상의 혐오증(food neophobia)으로 인해 영양학적 가치와 활용적 가치를 가지고 있음에도 불구하고, 제품화되기에는 많은 어려움이 따르고 있다(Hwang et al ., 2015; Yi &Kim, 2018).
누에를 식품소재로 활용한 연구로는 누에 분말을 이용한 젤리의 이화학적 특성 및 관능 평가(Kim et al ., 2006), 대사증후군 개선을 위한 뽕잎, 오디, 누에 분말의 혼합 비율 최적화(Kim et al ., 2018), 누에 동충하초 분말 첨가량에 따른 설기떡의 품질 특성(Shin et al., 2008), 누에 열수 추출물을 첨가한 식빵의 품질특성(Kwon & Kim, 2016) 등이 있으나 뽕잎과 오디와 같은 다른 양잠 소재에 비해 매우 제한적이었다.
로스팅(roasting) 처리는 식품의 화학적 성분 조정, 물리적 성질, 색, 향기 및 조직감 등과 같은 다양한 품질에 영향을 미치는 것으로 보고되고 있다(Park et al. , 1999: Chung et al ., 2006). 이러한 열처리 가공 기술은 식품의 저장 수명을 연장하고 생리활성 물질의 함량을 향상시키기 위한 목적으로 이용되어 왔다(Hwang et al., 2011).
이에 본 연구에서는 로스팅 처리 방법을 선택하여 동결건조 누에의 생리활성물질을 보존하면서 누에의 부정적인 맛과 향을 동시에 개선할 수 있는 로스팅 조건을 반응표면분석법(response surface methodology, RSM)을 이용하여 도출하고자 하였다.
Methods2. 실험설계동결건조 누에의 최적 로스팅 온도와 시간을 도출하기 위한 실험설계는 Design Expert 10 (Stat-Ease Inc., USA) 프로그램을 사용하였으며, 반응표면분석법(RSM)의 중심합성계획법에 따라 12개의 실험점을 설정하였다.
독립변수는 온도(X1), 시간(X2)으로 설정하였고, 예비실험을 거쳐 각 요인의 최소 및 최대 로스팅 온도 140-180℃, 시간 20-40min으로 설정하였다.
종속변수는 total polyphenol 함량, total flavonoid 함량, DPPH radical 소거능, ABTS radical 소거능, α-glucosidase 저해 활성으로 설정하였다. 실험설계에 따른 실험점은 Table 1에 제시된 바와 같다.
3. 실험방법1) 동결건조 누에 로스팅로스팅 조건을 표준화하기 위해 동결건조 누에는 20 g씩 계량한 후 열풍식 로스터기(CBR-101; Gene Cafe Co. Ltd., Korea)를 이용하여 조건별로 로스팅을 하였다.
2) 열수 추출물 제조분석에 사용한 열수추출물 제조는 각 조건별로 로스팅 한 누에를 분쇄기를 이용하여 60 s 동안 분쇄를 실시하였다. 제조된 분말은 40 mesh 체를 통과한 것을 사용하였으며 중량 대비 20배의 증류수를 첨가하여 환류 냉각관을 부착한 80℃의 heating mantle(HM 250C; Sercrim Lab Tech, Korea)에서 2 h 동안 추출시킨 후 3회 여과(No. 2; Whatman, England)하여 누에 열수 추출액을 얻었다. 열수 추출액은 원심분리기(Combi 514R; Hanil Science Medical Co. Ltd., Korea)에서 15 min 동안 원심분리(3,500 rpm)하여 얻은 상등액을 분석에 사용하였다.
3) 항산화 활성 측정RSM에 의해 설계된 12개의 로스팅 누에 열수 추출물의 total polyphenol 함량은 Folin-Denis의 방법을 변형하여 측정하였다(Singleton & Rossi, 1965). 추출물 350 μL에 50% Folin-Ciocalteu 시약 70 μL를 가하여 3 min간 정치한 다음 2% (w/v) Na2CO3 용액 350 μL를 첨가하여 60 min 반응시킨 후 750 nm에서 흡광도를 측정하였다. Total polyphenol 함량은 tannic acid를 이용하여 작성한 표준 곡선으로부터 구하였고, mg TAE (tannic acid equivalent)/g으로 나타냈다.
Total flavonoid 함량은 Davis (1947)의 방법을 변형하여 측정하였다. 추출물 70 μL에 diethylene glycol 700 μL를 첨가하고 다시 1 N NaOH 용액 7 μL를 첨가한 후 37℃의 dry oven에서 1 h 반응시킨 후 420 nm에서 흡광도를 측정하였다. Total flavonoid 함량은 quercetin을 이용하여 작성한 표준 곡선으로부터 구하였고, mg QE (quercetin acid equivalent)/g으로 나타냈다.
1,1-diphenyl-2-picrylhydrazyl (DPPH; Sigma-Aldrich, USA) radical 소거능은 Blois (1958)의 방법을 변형하여 측정하였다. 시료 100 μL에 1.5×10-4 M DPPH 용액 100 μL를 가하여 실온의 암실에서 30 min 정치한 후 517 nm에서 흡광도를 측정하였다.
2,2'-azino-bis-3-ethylbenzo-thiazoline-6-sulfonic acid(ABTS; Sigma-Aldrich) radical 소거능은 Fellegrini et al . (1999)의 방법으로 측정하였다. ABTS 7.4 mM과 potassium persulphate 2.6 mM을 같은 비율로 섞어 하루 동안 암소에 방치하여 ABTS 양이온을 형성시킨 후 732 nm에서 흡광도 값이 0.70±0.03이 되도록 1×PBS로 희석하였고, 희석된 ABTS 용액 190 μL에 추출물 시료 10 μL를 가하여 60 min 정치한 후 732 nm에서 흡광도를 측정하였다.
4) α-glucosidase 저해 활성 측정RSM에 의해 설계된 12개의 로스팅 누에 열수 추출물의 α-glucosidase 억제 효능은 Li et al . (2005)의 방법을 변형하여 측정하였다. 각각의 well에 시료 40 μL와 100 mM phosphate buffer (pH 6.8) 100 μL를 넣은 후 10 mM phosphate buffer (pH 6.8)에 녹인 0.2 unit/mL의 α-glucosidase 20 μL를 넣고 37℃에서 5 min 동안 preincubation을 시켰다. 기질로 사용된 2.5 mM p-nitrophenyl α-D-glucopyranoside (pNPG)는 100 mM phosphate buffer (pH 6.8)에 녹여 40 μL를 넣은 후 37℃에서 20 min 동안 incubation 시킨 후 microplate reader (Tecan Infinite M200 Pro; GreenMate Biotech Corp., Korea)를 이용하여 405 nm에서 흡광도를 측정하여 저해율을 산출하였다.
Results and Discussion1. 온도와 시간에 따른 로스팅 누에 열수 추출물의 생리활성 및 회귀 분석1) Total polyphenol 함량식물에서 항산화 물질로 잘 알려진 폴리페놀은 체내의 활성산소를 자유 라디칼로 안정시켜 산화 스트레스로 인한 손상을 예방하는 효과가 있다(Yoo et al., 2002; Jung et al., 2019).
본 연구에서는 RSM에 의해 설계된 12개의 로스팅 누에 열수 추출물의 total polyphenol 함량을 측정하여 Table 2에 제시하였고, 유의성 검증을 한 결과와 회귀 분석을 통해 얻은 결과들을 Table 3과 Figure 1에 제시하였다.
시료들의 total polyphenol 함량 측정 결과는 469.52-450.12 mg TAE/g 범위의 값을 보였으며, 6번 시료(180℃, 40 min)가 464.89 mg TAE/g으로 가장 높았고, 5번 시료(140℃, 30 min)가 450.12 mg TAE/g으로 가장 낮게 나타났다.
Total polyphenol 함량은 독립변수가 각각 작용하여 선형효과만 있는 linear model이 선정되었고, R2값은 0.7376으로 모델에 대한 높은 신뢰도를 보였으며, p 값은 0.0024로 유의하였고 모델의 적합성이 인정되었다. Figure 1에 제시된 perturbation plot에 따르면 온도(A)가 높고 시간(B)이 증가할수록 total polyphenol 함량이 높아져 RSM에 의해 설계된 12개의 로스팅 누에 열수 추출물의 total polyphenol 함량은 대체로 로스팅 시간이 길어질수록 증가하는 경향이 나타났다.
2) Total flavonoid 함량Flavonoid는 활성산소종을 효과적으로 제거하여 항산화능이 높다고 알려져 있으며, 폴리페놀과 마찬가지로 항바이러스, 항염증, 항암 효과가 있는 것으로 알려져 있다(Heim et al., 2002; Kim et al ., 2012).
본 연구에서는 RSM에 의해 설계된 12개의 로스팅 누에 열수 추출물의 total flavonoid 함량을 측정하여 Table 2에 제시하였고, 유의성 검증을 한 결과와 회귀 분석을 통해 얻은 결과들을 Table 3과 Figure 2에 제시하였다.
시료들의 total flavonoid 함량 측정 결과는 292.76-214.38 mg QE/g 범위의 값을 보였으며, 4번 시료(180℃, 20 min)가 292.76 mg QE/g으로 가장 높았고 9번 시료(140℃, 40 min)가 214.38 mg QE/g으로 가장 낮게 나타났다.
Total flavonoid 함량은 독립변수 간에 선형효과와 교호작용이 있는 2FI (two factor interaction) model이 선정되었고, R2값은 0.9730으로 모델에 대한 높은 신뢰도를 보였으며, p <0.0001로 유의하였고 모델의 적합성이 인정되었다. Figure 2에 제시된 perturbation plot에 따르면 온도(A)가 높을수록 total flavonoid 함량이 높아졌고, 시간(B)은 증가할수록 함량이 낮아졌다.
3) DPPH radical 소거능유리 라디칼은 인체 내에서 지질 또는 단백질 등과 결합하여 산화를 일으키기 쉽다. DPPH radical 소거능은 DPPH가 짙은 자색의 안정한 자유 라디칼로 항산화 물질에 의해 환원되면서 짙은 자색이 탈색되는 원리를 이용하여 측정하였다(Lee et al ., 2011; Kim et al ., 2018).
본 연구에서는 RSM에 의해 설계된 12개의 로스팅 누에 열수 추출물의 DPPH radical 소거능을 측정하여 Table 2에 제시하였고, 유의성 검증을 한 결과와 회귀 분석을 통해 얻은 결과들을 Table 3과 Figure 3에 제시하였다.
시료들의 DPPH radical 소거능을 측정한 결과는 71.04-66.14%범위의 값을 보였으며, 12번 시료(160℃, 30 min)가 71.04%로 가장 높았고 5번 시료(140℃, 30 min)가 66.14%로 가장 낮게 나타났다.
DPPH radical 소거능은 독립변수 간에 선형효과와 곡선효과가 나타나는 quadratic model이 선정되었고, R2값은 0.7066으로 모델에 대한 높은 신뢰도를 보였으며, p 값은 0.0040으로 유의하였고, 모델의 적합성이 인정되었다. Figure 3에 제시된 perturbation plot에 따르면 온도(A)가 올라갈수록 DPPH radical 소거능이 높아지다가 중심점을 지나면서 서서히 낮아지는 경향을 보였으며 시간(B)은 영향을 미치지 않았다.
4) ABTS radical 소거능ABTS radical 소거능은 potassium persulfate와의 반응으로 인해 생성된 ABTS 유리 라디칼이 추출물 내의 항산화 물질에 의해 제거되어 라디칼 특유의 색인 청록색이 탈색되는 것을 이용하여 측정할 수 있다(Lee & Ryu, 2019).
본 연구에서는 RSM에 의해 설계된 12개의 로스팅 누에 열수 추출물의 ABTS radical 소거능을 측정하여 Table 2에 제시하였고, 유의성 검증을 한 결과와 회귀 분석을 통해 얻은 결과들을 Table 3과 Figure 4에 제시하였다.
누에 열수 추출물의 ABTS radical 소거능을 측정한 결과 75.43-70.42% 범위의 값을 보였으며, 5번 시료(140℃, 30 min)가 75.43%로 가장 높았고 4번 시료(180℃, 20 min)가 70.42%로 가장 낮게 나타났다. ABTS radical 소거능은 DPPH radical 소거능과 마찬가지로 인위적인 라디칼을 제거하는 작용이 있으며, DPPH radical 소거능과 유의적인 상관성을 보이는 것으로 알려져 있다(Lee et al., 2011; Park et al., 2014).
5) α-glucosidase 저해 활성α-glucosidases는 소장 내에서 탄수화물로부터 α-glucose를 방출하는 α-glucosidic bond의 분해를 촉진하여 포도당을 흡수하는데 관여하는 생체 내 필수 효소이다(Kim et al., 2015).
본 연구에서는 RSM에 의해 설계된 12개의 로스팅 누에 열수 추출물의 α-glucosidase 저해 활성을 분석하여 Table 2에 제시하였고, 유의성 검증을 한 결과와 회귀 분석을 통해 얻은 결과들을 Table 3과 Figure 5에 제시하였다.
시료들의 α-glucosidase 저해 활성을 측정한 결과는 60.24-53.88% 범위의 값을 보였으며, 5번 시료(140℃, 30 min)가 60.24%로 가장 높았고 6번 시료(180℃, 40 min)가 53.88%로 가장 낮게 나타났다.
α-glucosidase 저해 활성은 독립변수 간에 선형효과와 곡선효과가 나타나는 quadratic model이 선정되었고, R2값은 0.9897로 모델에 대한 높은 신뢰도를 보였으며, p <0.0001로 유의하였고 모델의 적합성이 인정되었다. Figure 5에 제시된 perturbation plot에 따르면 온도(A)가 높고 시간(B)이 증가할수록 α-glucosidase 저해활성은 낮아졌다.
2. 온도와 시간에 따른 동결건조 누에의 로스팅 조건 최적화본 연구는 RSM을 이용하여 누에의 최적 로스팅 조건을 구하고자 항산화 지표로 total polyphenol 함량, total flavonoid 함량, DPPH radical 소거능, ABTS radical 소거능, 항당뇨 지표로 α-glucosidase 저해 활성을 활용하였다. 로스팅 누에의 범위를 온도 140-180℃, 시간 20-40 min으로 설정하여 항산화 활성이 최대로 발현되는 최적 로스팅 조건을 예측하고자 하였으며, 최고의 desirability를 나타낸 최적점을 선택하여 최적 로스팅 조건을 산출하였다(Figure 6). 로스팅 누에의 항산화 활성과 항당뇨 활성이 최대로 발현되는 최적 로스팅 조건은 180℃, 30 min이었다. 이때의 total polyphenol 함량은 466.61 mg TAE/g, total flavonoid 함량은 274.64 mg QE/g, DPPH radical 소거능은 69.43%, ABTS radical 소거능은 72.94%, α-glucosidase 저해 활성은 57.19%로 예측되었다.
Conclusion본 연구의 목적은 반응표면분석법(RSM)을 이용하여 동결건조 누에의 품질개선을 위해 로스팅 최적 조건을 도출하는 것이다. 독립변수로는 온도(X1)와 시간(X2)으로 설정하였는데, 예비실험을 거쳐 온도와 시간의 최소 및 최대 범위는 각각 140-180℃ (온도)와 20-40 min (시간)으로 설정하였다. 품질 개선효과를 알아보고자 종속변수로는 total polyphenol 함량, total flavonoid 함량, DPPH radical 소거능, ABTS radical 소거능 및 α-glucosidase 저해 활성으로 설정하였다.
본 연구결과, 동결건조 누에의 항산화 활성과 항당뇨 활성(α-glucosidase 저해 활성)이 최대로 발현되는 최적점(로스팅 조건)은 온도(X1)는 180℃였고, 시간(X2)은 30 min이었다. 이 최적점의 total polyphenol 함량은 466.61 mg TAE/g, total flavonoid 함량은 274.64 mg QE/g, DPPH radical 소거능은 69.43%, ABTS radical 소거능은 72.94%, α-glucosidase 저해 활성은 57.19%로 예측되었다.
누에는 혈당 강하작용과 항산화 작용 등의 뛰어난 효능을 가지고 있지만 비릿한 맛과 역한 냄새로 인하여 누에 그대로의 섭취가 쉽지 않은 결점이 있는 소재였다. 이 단점을 로스팅 처리하여 보완하기 위한 첫 번째 시도가 본 연구의 의의라 할 수 있겠다. 차후 본 연구 결과가 식품산업계에서 혈당 개선용 제품의 소재로 다양하게 활용되길 기대해 본다.
NOTESAuthor's contribution
KHL as the first author, collected freeze-dried silkworm samples focusing on the study design of the messenger, and carried out all the experiments in the paper herself. The second author, AJK, was responsible for reviewing the experimental design in detail and correcting the errors directly. MJK, a messenger, personally conducted and accepted the research and design supervision of this paper. All authors read and approved the final manuscript.
Author's contribution
Kyung-Hee Lee (Graduate student), Department of A lternat ive Med ic ine, Kyongg i Un ivers ity, 24, Kyonggidaero-9 gil, Seodaemun-gu, Seoul 03746, Korea; Ae-Jung Kim (Professor), Department of Nutrition Therapy, The Graduate School of Alternative Medicine, Kyonggi University, 63, Kyonggidae-ro-9 gil, Seodaemun-gu, Seoul 03752, Korea; Min-Ju Kim (Visiting Professor), Department of Alternative Medicine, Kyonggi University, 24, Kyonggidae-ro-9 gil, Seodaemun-gu, Seoul 03746, Korea.
Figure 1.Perturbation and response surface plot on total polyphenol content of DW extracts of freeze-dried silkworm.TAE, tannic acid equivalent.; DW, distilled water.
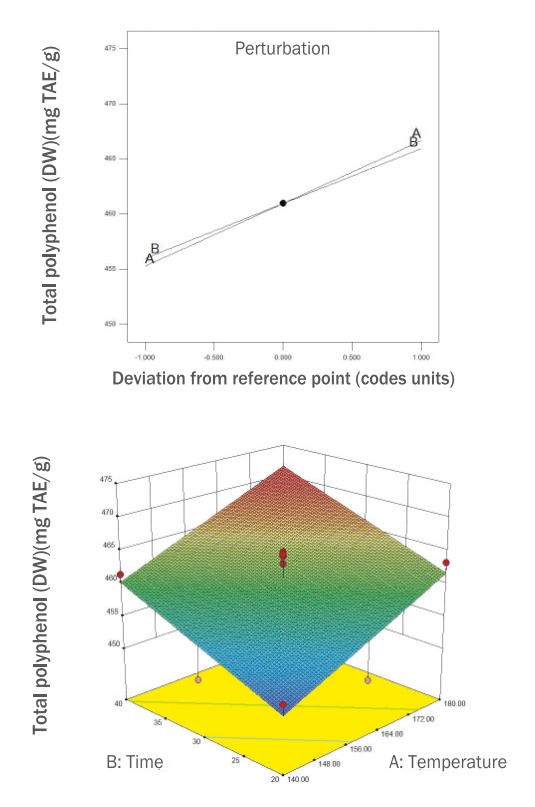
Figure 2.Perturbation and response surface plot on total flavonoid content of DW extracts of freeze-dried silkworm.QE, quercetin acid equivalent; DW, distilled water
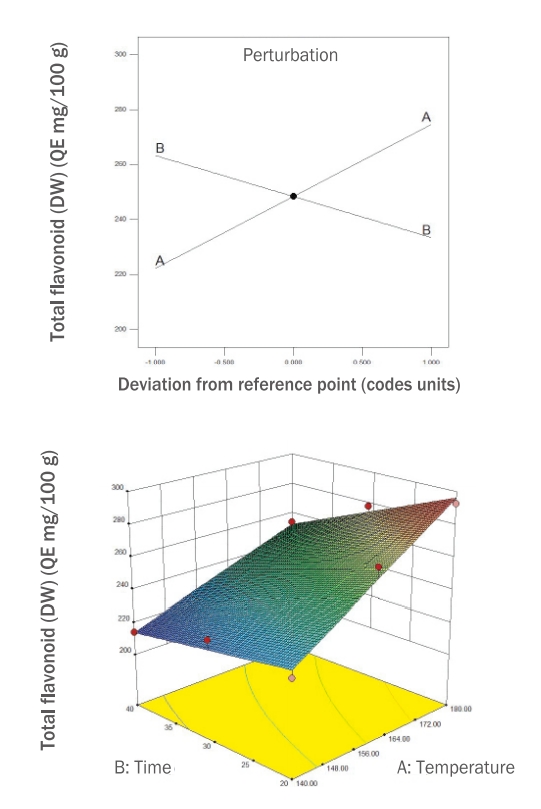
Figure 3.Perturbation and response surface plot on DPPH radical scavenging activity of DW extracts of freeze-dried silkworm.DW, distilled water; DPPH, 2,2,1-diphenyl-1-picrylhydrazyl.
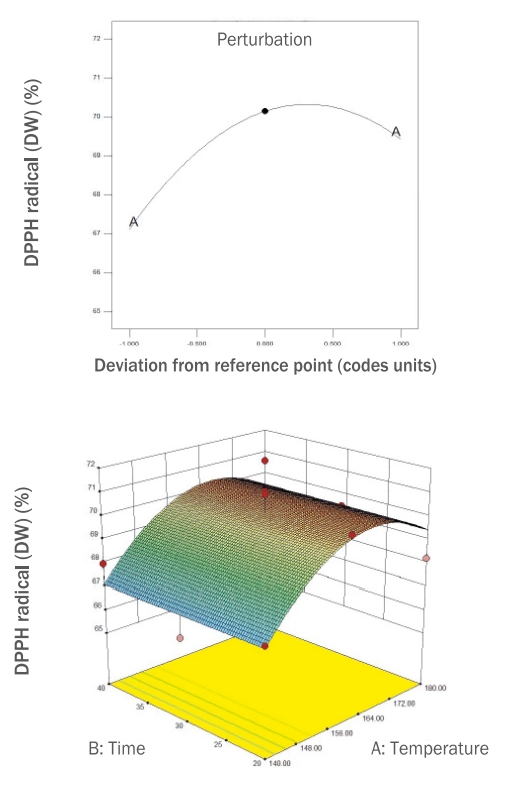
Figure 4.Perturbation and response surface plot on ABTS radical scavenging activity of DW extracts of freeze-dried silkworm.DW, distilled water; ABTS, 2,2'-azino-bis-3-ethylbenzo-thiazoline-6-sulfonic acidpicrylhydrazyl.

Figure 5.Perturbation and response surface plot on α-glucosidase inhibitory activity of DW extracts of freeze-dried silkworm.DW, distilled water.
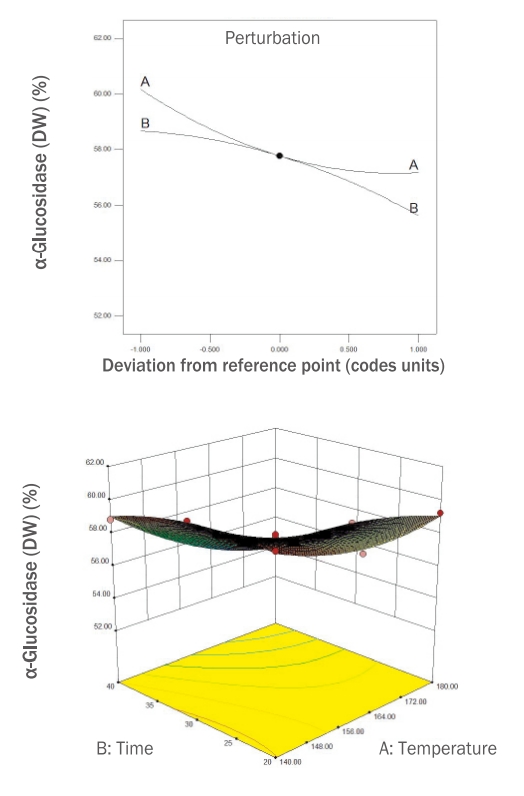
Figure 6.Overlay plot of optimized of temperature (A) and time (B) on antioxidant and antidiabetic activities.DW, distilled water; DPPH, 2,2,1-diphenyl-1-picrylhydrazyl; ABTS, 2,2'-azino-bis-3-ethylbenzo-thiazoline-6-sulfonic acidpicrylhydrazyl.
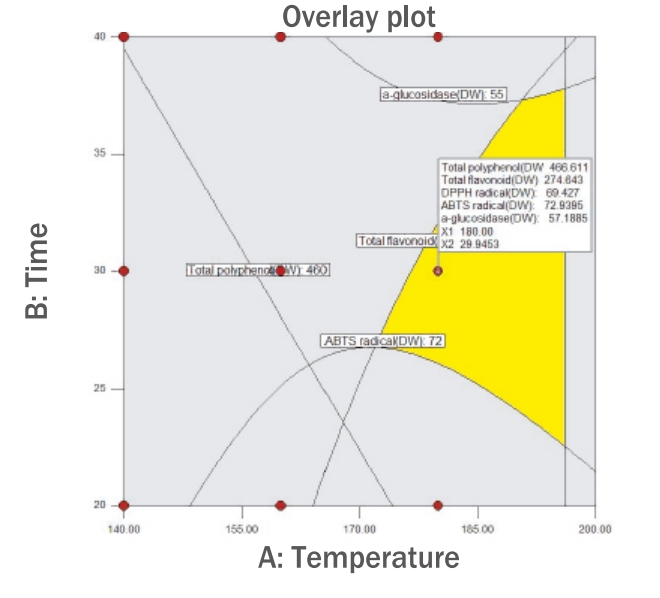
Table 1.Independent variables and actual values used for optimization Table 2.Antioxidant activities and α-glucosidase inhibitory activity of temperature, time by response surface design Table 3.Analysis of predicted model equation for Antioxidant activities and α-glucosidase inhibitory activity of temperature, time
ReferencesBlois MS. Antioxidant determination by the use of a stable free radical. Nature 181: 1199-1200. 1958.
Capuano E, Fogliano V. Acrylamide and 5-hydroxymethylfurfural (HMF): a review on metabolism, toxicity, occurrence in food and mitigation strategies. LWT-Food Science and Technology 44: 793-810. 2011.
Cha JY, Kim YS, Kang PD, Ahn HY, Eom KE, Cho YS. Biological activity and chemical characteristics of fermented silkworm powder by mold. Journal of Life Science 20: 237-244. 2010.
Cho EK, Choi YJ. Antioxidant, antidiabetic, and antiinflammatory effects of extracts and fractions from Parthenocissus tricuspidata stems. Journal of Life Science 23: 399-405. 2013.
Cho MR, Choue RW, Chung SH, Ryu JW. Effects of silkworm powder on blood glucose and lipid levels in NIDDM (Type II) patients. Journal of Nutrition and Health 31: 1139-1150. 1998.
Chung HS, Kim JK, Youn KS. Effects of roasting temperature on phycochemical properties of job's tears (Coix lachryma jobi L. var ma-yeun) powder and extracts. Korean Journal of Food Preservation 13: 477-482. 2006.
De Groot M, Anderson R, Freedland KE, Clouse RE, Lustman PJ. Association of depression and diabetes complications: a meta-analysis. Psychosomatic Medicine 63: 619-630. 2001.
Fellegrini N, Ke R, Yang M, Rice-Evans C. Screening of dietary carotenoids and carotenoid-rich fruit extracts for antioxidant activities applying 2,2'-azinobis(3-ethylenebenzothiazoline-6-sulfonic acid) radical cation decolorization assay. Methods in Enzymology 299: 379-389. 1999.
Hwang IG, Woo KS, Jeong HS. Biological activity and heat treatment processing of foods. Food Science and Industry 44: 56-65. 2011.
Hwang SY, Bae GK, Choi SK. Preferences and purchase intention of Tenebrio molitor (mealworm) according to cooking method. Korean Journal of Culinary Research 21: 100-115. 2015.
Jang MJ, Rhee SJ. Hypoglycemic effects of pills made of mulberry leaves and silkworm powder in streptozotocininduced diabetic rats. Journal of the Korean Society of Food Science and Nutrition 33: 1611-1617. 2004.
Jung YH, Han JS, Kim AJ. Quality evaluation and antioxidant activity of inner beauty tea prepared from roasted lotus root and burdock. Asian Journal of Beauty and Cosmetology 17: 235-245. 2019.
Kang H, Kim SC, Kang YS, Kwon YI. Mode of action of water soluble β-glucan from oat (Avena sativa ) on calorie restriction effect in-vitro and in-vivo animal models. The Korean Journal of Food and Nutrition 30: 1222-1228. 2017.
Kim AJ, Yuh CS, Bang IS, Park SH. The physicochemical properties and sensory evaluation of jelly with silkworm powder. Journal of the East Asian Society of Dietary Life 16: 308-314. 2006.
Kim EJ, Choi JY, Yu MR, Kim MY, Lee SH, Lee BH. Total polyphenols, total flavonoid contents, and antioxidant activity of Korean natural and medicinal plants. Korean Journal of Food Science and Technology 44: 337-342. 2012.
Kim HY, Lim SH, Park YH, Ham HJ, Lee KJ, Park DS, Kim KH, Kim S. Screening of α-amylase, α-glucosidase and lipase inhibitory activity with Gangwon-do wild plants extracts. Journal of the Korean Society of Food Science and Nutrition 40: 308-315. 2011.
Kim MJ, Im KR, Yoon KS. Effect of medicinal herb prepared through traditional antidiabetic prescription on α-glucosidase activity and evaluation method for antimelanogenesis agents using α-glucosidase activity. Journal of the Korean Society of Food Science and Nutrition 44: 993-999. 2015.
Kim MJ, Kim HS, Kim AJ. Optimization of mixing ratio of mulberry leaf, mulberry fruit, and silkworm for amelioration of metabolic syndrome. Journal of Society of Korean Medicine for Obesity Research 18: 83-95. 2018.
Kim SA, Shin YW, Lee IA. Effects of Cudrania tricuspidata leaf extract on gluten sensitivity. Journal of the Korean Society of Food Science and Nutrition 47: 512-518. 2018.
Kwon YJ, Kim HJ. Quality characteristics of white pan bread containing heat treated silkworm steam extract. Food Service Industry Journal 12: 87-97. 2016.
Lee YH, Yoon SJ, Kim A, Seo H, Ko S. Health performance and challenges in Korea: a review of the global burden of disease study 2013. Journal of Korean Medical Science 31: S114-S120. 2016.
Lee YM, Bae JH, Jung HY, Kim JH, Park DS. Antioxidant activity in water and methanol extracts from Korean edible wild plants. Journal of the Korean Society of Food Science and Nutrition 40: 29-36. 2011.
Lee YS, Ryu MJ. Antioxidant Effects of Cinnamomum cassia bark extract and its effectiveness as a cosmetics ingredient. Asian Journal of Beauty and Cosmetology 17: 69-80. 2019.
Li T, Zhang X, Song Y, Liu J. A microplate-based screening method for α-glucosidase inhibitors. Chinese Journal of Clinical Pharmacology and Therapeutics 10: 1129-1131. 2005.
Park CH, Kim KH, Yook HS. Comparison of antioxidant and antimicrobial activities in Siraegi (dried radish greens) according to cooking process. The Korean Journal of Food and Nutrition 27: 609-618. 2014.
Park JH, Han JS, Choi HK. Effect on quality of pan-fired green tea by 1st pan-firing time. Korean Journal of Medicinal Crop Science 7: 101-106. 1999.
Shin SM, Kim AJ, Cho HC, Joung KH. Quality characteristics of Seolgiddeok prepared with added Paecilomyces japonica powder. The Korean Journal of Food and Nutrition 21: 22-27. 2008.
Singleton VL, Rossi JA. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture 16: 144-158. 1965.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||