요약목적본 연구는 UVB로 인해 손상된 인간 각질형성세포(HaCaT)에 대한 prunin의 광노화에 효과가 있는지를 확인하여 노화에 효과적인 화장품 소재로서 활용 가능성을 알아보기 위함이다.
방법Prunin의 UVB에 의한 증가된 MMP1 mRNA 발현과 UVB에 의해 감소된 COL1A1 mRNA의 발현은 quantitative real-time polymerase chain reaction (qRT-PCR)을 통해 확인하였고, luciferase reporter assay를 통해 MMP1 mRNA의 변화가 AP-1 전사 활성과 관련이 되어 있는지 분석하였다. 또한 ELISA 분석으로 type I procollagen의 생성량 변화를 확인하였다.
AbstractPurposeThe aim of this study was to investigate the effects of prunin on photoaging in human keratinocytes (HaCaT) damaged by UVB radiation, so as to find out whether prunin can be used as an effective anti-aging ingredient in cosmetic products.
MethodsQuantitative real-time polymerase chain reaction (qRT-PCR) was used to identify the increased expression of MMP1 mRNA and decreased expression of COL1A1 mRNA due to UVB, and luciferase reporter assay was used to determine whether the change in MMP1 mRNA is related to AP-1 transcriptional activity. Furthermore, ELISA analysis was used to determine the change in type I procollagen production.
ResultsPrunin protected cells from UVB-induced cytotoxicity, and the increased expression of MMP1 mRNA due to oxidative stress in UVB-damaged HaCaT decreased in a concentration-dependent manner. AP-1 transcriptional activity also decreased in a concentration-dependent manner. The expression of Type I procollagen and COL1A1 mRNA increased in a concentration-dependent manner.
ConclusionThis study found that prunin has an inhibitory efficacy on photoaging due to UV radiation, which is a leading cause of oxidative stress. Thus prunin can be used as an effective cosmetic raw material for inhibiting photoaging. However, it will be necessary to conduct experiments on the human body to find a practical way of applying prunin as a cosmetic raw material for the skin.
Introduction나이가 들어감에 따라 피부에서 노화가 진행되면 기능적인 특징과 정상적인 구조가 감소한다. 이는 생물학적으로 명확히 구별되는 것으로 내인성 노화와 외인성 노화에 의해 일어난다. 내인성 노화는 나이가 들어감에 따라 자연스럽게 발생하는 노화로 이는 자연노화 과정에 의해 나타나며 다른 장기에서 나타나는 노화와 비슷한 형태로 피부에 영향을 준다. 외인성 노화는 다양한 환경적인 요소 중 특히 UVB가 노화를 일으키는 주요원인으로 외부적인 요소에 의해 발생하는 광노화에 의한 노화를 말한다(El-Domyati et al., 2002). UVA와 UVB는 일시적, 영구적인 유전자의 손상과 분화, 성장, 노화 및 결체조직 퇴행과 관계된 세포질내에서 신호 전달 경로를 활성화시킨다(Wlaschek et al., 2001). 자외선이 피부의 세포 내 신호 전달체계에 영향을 주어 DNA 손상, 유전자 발현을 손상시켜 세포의 노화와 세포의 사멸을 일으킨다(Lee et al., 2012).
피부는 표피, 진피, 피하조직으로 구분되며, 그 중 진피에서 세포외기질(extra cellular matrix)의 구성 성분인 콜라겐은 강도와 장력을 피부에 주는 것으로 진피의 약 90% 정도를 차지한다. 콜라겐의 중요한 구성 성분으로 collagen type-I (제1형 콜라겐, COL1A1)이 대부분을 차지하고 있으며 조직의 기능, 구조를 유지하는데 중요한 단백질의 역할을 한다(Mays et al., 1988). 단백질 분해 효소인 matrix metalloproteinase (MMP), 세린 단백질 분해 효소, 시스틴 단백질 분해 효소는 세포외기질을 파괴한다(Charous et al., 1997). 이 중 노화의 중요한 역할을 하는 것으로 collagenase group에서는 MMP-1, MMP-8, MMP-13이 포함되어 있고, 제 I형, II형, III형 콜라겐을 분해한다(Kusukawa et al., 1996). MMP 계열에서 발현증가는 자외선과 같은 산화적 스트레스로 유도되며, 자외선은 MMP-1의 합성을 증가시켜서 피부의 콜라겐을 분해하여 type Ⅰ procollagen의 합성을 감소시킨다(Rittié & Fisher, 2002). 노화가 진행될 때 활성 산소는 activator protein 1 (AP-1)을 구성하는 단백질의 발현의 증가와 일치하는 연구결과가 보고되었다(Fisher et al., 1996). 자외선과 같은 피부를 자극하는 산화적인 스트레스에 의해 mitogen activated protein (MAP) kinase의 경로를 활성화해 AP-1 발현을 유도하고 MMP의 발현을 증가시켜서 세포외기질을 분해하여 결국 피부에 주름생성을 촉진시킨다(Choi et al., 1991).
Prunin은 플라보노이드(flavonoid)의 플라바논(flavanones) 배당체로서 왕벚나무 Prunus yedoensis Matsumura (장미과) 등의 벚꽃재에 많이 함유되어 있다. Prunus davidiana Fr. (장미과)의 줄기는 한국의 민간요법에서 신경염, 류머티스 등의 치료에 사용되며 Prunin davidiana의 줄기에는 플라 보닌(naringenin 7-O-glucoside)이 항산화, 항염증 및 심장 보호효과 등 여러 종류의 플라보노이드를 함유하고 있다(Roshchin & Gerashchenko, 1973; Jung et al., 2003). Prunin에 대해서는 항산화, 항균 효과, 혈당저하 및 혈행 개선에 대한 효과가 보고되었다(Han et al., 2008; Han et al., 2012). 또한 prunin에 관한 연구는 약학, 화학, 의학 등에서의 항염(Céliz et al., 2010; Céliz et al., 2011), 항산화(Céliz et al., 2013), 혈행 개선(Itoh et al., 2010), 당뇨와 관련된 혈당 및 인슐린 저하(Choi et al., 1991) 등에 대한 것이 대부분이고 화장품 원료로서의 가능성에 관한 연구는 매우 미흡합니다. 따라서 본 연구에서는 prunin이 MMP 발현, AP-1 전사활성을 조절하고 Type I procollagen 및 COL1A1의 유전자 발현의 변화를 확인하여 항노화에 관련된 기능성 화장품 원료로서의 활용 가능성을 검증하고자 한다.
Methods1. 세포배양본 연구에 사용한 세포는 인간 각질형성세포주인 HaCaT keratinocytes cell line (ATCC, USA)을 사용하였다. HaCaT 세포주의 배양은 Dulbecco's Modified Eagle Medium (DMEM; Hyclone, USA)에 스트렙토마이신/페니실린(streptomycin 100 μg/mL, penicillin 100 IU/mL; Invitrogen, USA) 1%와 fetal bovine serum (FBS; Hyclone) 10%가 함유한 배지를 사용하였으며, 배지 환경은 5% CO2, 37℃가 유지되는 조건에서 배양하였다.
2. 시료 처리Prunin는 순수정제(>95%)된 분말의 형태로 Sigma-Aldrich (USA)로부터 구매하였고 실험에 사용할 때에는 dimethyl sulfoxide (DMSO; Sigma-Aldrich)에 정적한 농도로 용해시켜 실험에 사용하였다. 세포배양 접시에 24 h 동안 HaCaT cell (1×106 cells/well)을 배양한 후에 적정 실험농도에 맞춰 Prunin을 배지에 첨가하여 전 처리를 6 h 동안 UVB를 처리 후 24 h이 지난 후에 실험을 진행하였다. HaCaT에 UVB 조사를 하기 위해서 세포배양접시의 배지를 제거 하였다. 제거 방법은 pH가 7.4인 phosphate buffered saline (PBS)로 2회 세척하였다. 세포의 건조를 막기 위해서 1 mL의 PBS를 세척된 HaCaT에 넣은 다음 세포배양접시의 뚜껑을 연 후 UVB를 조사하였다. UVB 조사한 후 PBS를 제거한 다음 다시 배지를 첨가하여 배양기에서 24 h 추가 배양한 다음 실험에 사용하였다.
3. 세포 생존율 측정세포 생존율 측정은 water-soluble tetrazolium salt-1 (WST-1) assay의 원리를 이용하여 측정하였다. WST-1 assay는 세포 내에 존재하는 미토콘드리아 탈수소효소와 수용성인 tetrazolium salts가 반응해서 형성된 발색물질인 formazan을 이용해 측정하는 실험방법이다. 96-well plate에 3×103 cells/well의 농도로 HaCaT를 100 μL씩 접종한 다음 24 h 배양한 후 prunin을 각각 1, 5, 10, 20, 40 μM 농도로 처리하고, UVB 조사한 다음 24 h 동안 추가 배양하였다. 1 h 동안 세포배양접시에 10 μL의 EZCytox cell viability assay kit reagent (ItsBio, Korea)를 첨가하여 배양한 후 microplate reader (Bio-Rad, USA)를 이용하여 490 nm에서 흡광도를 측정하였다.
4. Quantitative real-time polymerase chain reaction (qRT-PCR)Prunin에 의한 HaCaT에서의 유전자 발현패턴을 정량적으로 분석하기 위해 qRT-PCR을 이용하였다. qRT-PCR은 PCR tube에 0.5 U Ex taq DNA polymerase, 0.2 μM primers, 0.8 mM dNTP, 3mM MgCl, 20 mM Tris/HCl pH 8.4, 50 mM KCl, 1X SYBR green (Invitrogen)을 혼합해 반응액을 제조하였고, PCR은 Linegene K (BioER, China)를 사용하여 진행하였다. PCR의 유효성의 검증은 melting curve로 하였다, 각각의 유전자 발현은 β-actin의 발현을 표준화해서 비교분석 하였다. 실험에 사용한 primer는 Table 1과 같다.
5. AP-1 활성 측정Prunin이 AP-1의 활성에 영향을 주는지 확인을 위한 목적으로 AP-1 luciferase assay를 사용하였다. AP-1 responsive elements가 luciferase gene 앞쪽에 자리하고 있는 vector (BPS Bioscience, USA)를 구매하여 사용하였으며 transfection한 다음 발현을 확인하였다. 96-well 세포배양접시에 농도는 3×104 cells/well 세포를 넣고 24 h동안 배양한 다음 세포를 안정화시킨 후 15 μL 배지에 1 μL reporter gene을 섞어 준비하고 15 μL 배지에 0.35 µL Llipofectamine 2000를 섞어 준비하였다. 상온에서 25 min DNA 희석액, Lipofectamine 2000 희석액 두가지를 섞어 반응시키고 30 µL씩 세포배양접시에 넣고 배양기에서 24 h 반응시킨다. 다음날 시약과 자극 등을 처리한 후 24 h 추가 배양한 다음 AP-1 promoter activity를 측정하였다.
6. Procollagen type Ⅰ 생산량 측정단백질에 특이적인 항체(antibody)를 사용하여 정량하는 측정 방법으로 Procollagen type-ⅠC-peptice enzme immunoassay kit (MK 101; Takara, Japan)을 사용하여 procollagen enzyme linked immunoassay (ELISA)를 진행하였다. Anti-PIP (procollagen type-I C-peptide) monoclonal antibody-coated plate에 각각 100 μL씩 배양배지를 분주하여 상온에서 2 h 경과 후 5번 1X washing buffer로 헹구어주고 peroxidase-labeled anti-PIP monoclonal antibody 을 넣고 후 3 h 동안 반응시킨다. 1 0 0 μL 의 3,3',5,5'-tetramethylbenzidine (TMB) substrate를 넣고 상온에서 15 min 반응시킨 다음에 흡광도를 450 nm에서 측정하였다.
Results and Discussion1. Prunin의 세포 생존율 분석Prunin이 인간각질세포(HaCaT keratinocytes)에 미치는 세포의 독성을 확인하기 위해 세포생존율을 WST-1 assay를 사용하여 측정하였다. prunin을 각각 1, 5, 10, 20, 40 μM 농도로 각각 처리하여 확인한 결과, prunin 1, 5, 10, 20, 40 μM 농도에서 100%, 102%, 102%, 93%의 생존율을 보였으나, 40 μM에서 75%로 세포생존율이 감소한 것으로 나타나 40 μM이상의 농도에서는 세포독성이 있다고 판단하였다 (Figure 1A). 또한 UVB에 의해 손상된 HaCaT에서 prunin의 세포보호 효능을 알아보기 위해 prunin을 각각 5, 10 μM의 농도로 전 처리 후 UVB를 40 mJ/cm2를 조사한 결과 UVB만 조사된 대조군에서 세포생존율이 53%, prunin을 5, 10 μM 전 처리한 경우 71%, 96%의 세포생존율을 보여 prunin에 의해 세포생존율이 농도 의존적으로 회복되는 것이 확인되었다(Figure 1B).
2. Prunin의 MMP1 mRNA 발현 변화산화 스트레스로 인해 MMP1, MMP3 등의 유전자 발현이 촉진된다. 이로 인해 피부의 주름이나 탄력저하 등이 나타나면서 피부의 노화를 유도한다(Fisher et al., 1996). Prunin이 UVB에 의해 증가된 MMP1 mRNA가 어느 정도 회복되는지 qRTPCR을 통해 확인한 결과 UVB 40 mJ/cm2에 의해서 발현량이 1에서 3.89으로 증가되었다. Prunin의 농도 5, 10 μM 전처리 후 40 mJ/cm2 UVB 조사하였을 때 발현량이 2.27, 1.52로 감소되었다. 즉, 농도 의존적으로 prunin이 MMP1 mRNA 발현을 감소하는 것으로 확인하였다(Figure 2). 이러한 결과는 prunin이 산화 스트레스에 의해 늘어난 MMP1 mRNA의 발현 감소가 자외선에 의한 노화에 효과가 있을 것으로 사료된다.
3. Prunin의 AP-1 전사활성 변화자외선과 같은 산화적인 스트레스로 인해 피부 자극은 MAP kinase 경로를 활성화시키므로 AP-1의 발현을 유도하여 MMP계열의 발현을 증가시켜 세포외기질을 분해하여 피부에 주름생성을 촉진시킨다(Choi et al., 1991). 산화 스트레스에 의해 증가된 활성산소가 AP-1를 전사활성 시켜 MMP1의 발현을 증가되는 것을 확인하기 위해 AP-1 전사활성 변화를 prunin이 UVB에 의해 증가된 AP-1전사활성이 어느 정도 회복되는지를 AP-1 luciferase assay를 통해서 확인한 결과 UVB 40 mJ/cm2에 의해 AP-1 전사활성이 1에서 2.67으로 증가되었다. Prunin의 농도 5, 10 μM 전처리 후 40 mJ/cm2 UVB 조사하였을 때 AP-1 전사활성이 1.73, 1.00으로 감소되었다. 즉, 농도의존적으로 prunin이 AP-1 전사활성을 감소시키는 것을 확인하였다(Figure 3). 따라서 prunin이 산화 스트레스에 의해 증가된 AP-1의 활성을 감소시켜서 MMP1의 발현을 감소시키는 것으로 확인하였다.
4. Prunin의 Type Ⅰ procollagen 변화Type I procollagen은 진피층의 세포외 기질에 가장 많이 차지하고 있다(Na et al., 2018). 자외선은 MMP-1의 합성을 증가시켜 사람의 피부에서 콜라겐을 분해하고 피부에서 type Ⅰ procollagen의 합성을 감소시킨다. 피부에서 콜라겐 합성의 감소와 상승된 MMP 발현은 자연적인 피부 노화로 인해 콜라겐의 손상이 발생하고(Chung et al., 2001), 그로 인해 피부 탄력 저하 및 주름을 생성시켜 피부의 노화를 가져온다(Lee et al., 2012; Saito et al., 2004; Varani et al., 2002). MMP1 활성으로 감소된 type Ⅰ procollagen의 변화를 확인하기 위해 prunin이 UVB의 자극을 받은 type Ⅰ procollagen을 어느 정도 회복하는지 ELISA를 통해 확인한 결과, UVB 40 mJ/cm2에 의해 type Ⅰ procollagen이 1에서 0.74로 감소되었다. Prunin의 농도 5, 10 μM 전처리 후 40 mJ/cm2 UVB 조사하였을 때 type Ⅰ procollagen이 0.84, 0.98로 증가되었다. 즉, 농도의존적으로 prunin이 type Ⅰ procollagen을 증가시키는 것으로 확인하였다(Figure 4). 따라서 prunin이 자외선에 의해 감소된 type Ⅰ procollagen이 증가하여 노화를 억제하는 효과가 있을 것으로 사료된다.
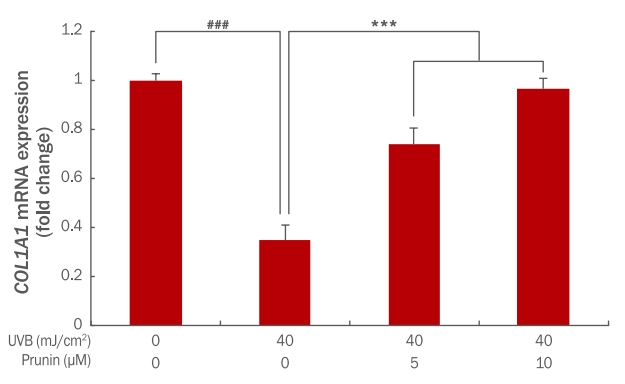
5. Prunin의 COL1A1 mRNA 발현 변화자외선을 조사하면 MMP 계열의 발현을 촉진시킬 뿐만 아니라 collagen의 생성 또한 억제한다(Yoon, 2013). Collagen은 진피의 세포의 증식, 분화, 세포의 접착력, 탄력과 치밀도 및 조직의 결합력 등에도 관여한다(Perlish et al., 1998). Collagen은 다양한 타입으로 존재하며 type Ⅰ collagen은 피부와 뼈에 존재하는 대표적인 collagen으로 collagen type1 alpha1 (COL1A1)과 collagen type1 alpha2 (COL1A2)의 유전자에 의해서 합성된다(Yoon, 2013). Prunin이 피부의 노화를 어느 정도 감소시키는지 그 효과를 알아보기 위해 typeⅠ collagen을 생성하는 COL1A1 mRNA 발현량을 확인하였다. Prunin이 UVB에 의해 증가된 COL1A1 mRNA가 어느 정도 회복되는지를 qRT-PCR을 사용하여 확인한 결과, UVB 40 mJ/cm2에 의해 COL1A1 mRNA 발현량이 1에서 0.34로 감소되었다. Prunin의 농도를 5, 10 μM 전처리 후 40 mJ/cm2 UVB 조사하였을 때 COL1A1 mRNA 발현량이 0.74, 0.96으로 증가되었다. 즉, 농도 의존적으로 prunin이 발현량을 증가시키는 것으로 확인하였다(Figure 5). 따라서 prunin이 자외선에 의해 감소된 COL1A1 mRNA의 발현을 증가함으로 광노화에 효능이 있는 것으로 사료된다.
Conclusion본 연구에서는 HaCaT에서 prunin을 농도별로 전 처리하고 UVB를 조사하여 세포손상을 유도한 후 증가된 MMP1 mRNA 발현, AP-1 전사활성을 확인하고 자외선에 의해 감소된 Type I procollagen, COL1A1의 유전자의 발현 변화를 확인하여 광노화에 효과가 있는지를 확인하였다. 그 결과 prunin이 UVB에 의해 손상된 HaCaT의 세포 손상을 보호하는 효과를 확인하였다. Prunin이 MMP1 mRNA 발현과 AP-1 전사활성을 감소하였고 Type I procollagen, COL1A1 mRNA 발현을 증가시켜 산화 스트레스에 의해 노화를 억제할 수 있는 것 확인되었다. 그러므로 prunin은 HaCaT에서 광노화에 효과를 가진 화장품 원료로서의 활용 가능성이 있음을 확인하였다.
Figure 1.Cell survival analysis of UVB-irradiated and prunin treated HaCaT cells.HaCaT cells were inoculated into 96-well plate at a 3×103 cells/well and incubated for 24 h. (A) Prunin was added at various concentrations and cells were cultured for 24 h. Survival rates were 100%, 102%, 102%, 93% and 75% at the concentrations of prunin 1, 5, 10, 20 and 40 μM, respectively. (B) The cells were pretreated with prunin at 5, 10 μM for 6 h and irradiated with 40 mJ/cm² of UVB. After 24 h of incubation, cell viability was determined using the WST-1 assay. Cell survival was restored in a dose-dependent manner. The results show the mean and standard deviation for three independent experiments. The graph represents the mean±SD of the relative cell viability in each sample from triplicate experiments. The Student's t-test was performed to determine statistical significance (**p<0.01; ***p<0.001; ###p<0.001). UVB, ultraviolet B; WST-1, water-soluble tetrazolium salt.

Figure 2.The effect of prunin on expression of MMP1 mRNA in UVB-irradiated HaCaT keratinocytes.HaCaT keratinocytes (2×105 cells) were inoculated into 60 mm culture dishes and then incubated for 24 h. Prior to UVB exposure, the cells were pre-treated at various concentrations of prunin. Then, the cells were washed with PBS and irradiated with 40mJ/cm² UVB. After 24 h further incubation, the expression level of MMP1 mRNA was determined by the qRT-PCR. The graph is representative of three independent experiments (mean±SD). The Student's t-test was performed to determine statistical significance (***p<0.001; ###p<0.001). MMP1, matrix metalloproteinase; UVB, ultraviolet B; qRT-PCR, quantitative real-time polymerase chain reaction; SD, standard deviation.
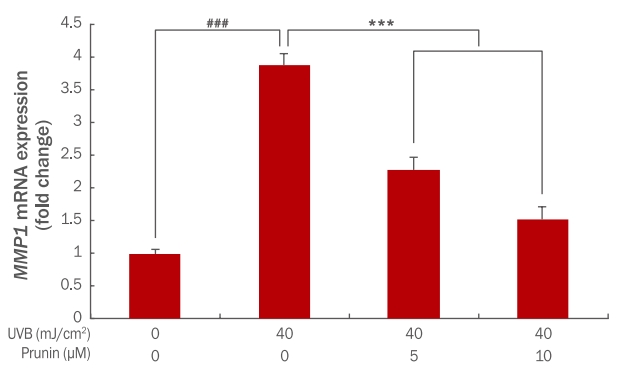
Figure 3.The effect of prunin on expression of AP-1 activity in UVB-irradiated HaCaT keratinocytes.HaCaT keratinocytes (2×105 cells) were inoculated into 60mm culture dishes and then incubated for 24 h. Prior to UVB exposure, the cells were pre-treated at various concentrations of prunin. Then, the cells were washed with PBS and irradiated with 40 mJ/cm² UVB. After 24 h further incubation, the AP-1 activity was determined by the AP-1 luciferase assay. The graph is representative of three independent experiments (mean±SD). The Student's t-test was performed to determine statistical significance (***p<0.001; ###p<0.001). AP-1, activator protein 1; UVB, ultraviolet B; PBS, phosphate buffered saline; SD, standard deviation.

Figure 4.The effect of prunin on expression of relative type I procollagen in UVB-irradiated HaCaT keratinocytes.HaCaT keratinocytes (2×105 cells) were inoculated into 60mm culture dishes and then incubated for 24 h. Prior to UVB exposure, the cells were pre-treated at various concentrations of prunin. Then, the cells were washed with PBS and irradiated with 40 mJ/cm² UVB. After further 24 h incubation, the relative type I procollagen was determined by the ELISA. The graph is representative of three independent experiments (mean±SD). The Student's t-test was performed to determine statistical significance(**p<0.01; ##p<0.01). NS, not significant; UVB, ultraviolet B; ELISA, enzyme-linked immunosorbent assay; PBS, phosphate buffered saline; SD, standard deviation.

Figure 5.The effect of prunin on expression of COL1A1mRNA in UVB-irradiated HaCaT keratinocytes.HaCaT keratinocytes (2×105 cells) were inoculated into 60 mm culture dishes and then incubated for 24 h. Prior to UVB exposure, the cells were pre-treated at various concentrations of prunin. Then, the cells were washed with PBS and irradiated with 40mJ/cm² UVB. After 24 h further incubation, the expression level of COL1A1 mRNA was determined by qRT-PCR. The graph is representative of three independent experiments (mean±SD). The Student's t-test was performed to determine statistical significance(***p<0.001; ###p<0.001). COL1A1, collagen type1 alpha1; UVB, ultraviolet B; qRT-PCR, quantitative real-time polymerase chain reaction; PBS, phosphate buffered saline; SD, standard deviation.
ReferencesCéliz G, Daz M, Audisio MC. Antibacterial activity of naringin derivatives against pathogenic strains. Journal of Applied Microbiology 111: 731-738. 2011.
Céliz G, Audisio MC, Daz M. Antimicrobial properties of prunin, a citric flavanone glucoside, and its prunin 6″-O-lauroyl ester. Journal of Applied Microbiology 109: 1450-1457. 2010.
Céliz G, Alfaro FF, Cappellini C, Daz M, Verstraeten SV. Prunin- and hesperetin glucoside-alkyl (C4-C18) esters interaction with Jurkat cells plasma membrane: consequences on membrane physical properties and antioxidant capacity. Food and Chemical Toxicology 55: 411-423. 2013.
Charous SJ, Stricklin GP, Nanney LB, Netterville JL, Burkey B. Expression of matrix metalloproteinases and tissue inhibitor of metalloproteinases in head and neck squamous cell carcinoma. The Annals of Otology Rhinology & Laryngology, 106: 271-278. 1997.
Choi JS, Yokozawa T, Oura H. Improvement of hyperglycemia and hyperlipemia in streptozotocin-diabetic rats by a methanolic extract of Prunus davidiana stems and its main component, pruning. Planta Medica 57: 208-211. 1991.
Chung JH, Seo JY, Choi HR, Lee MK, Youn CS, Rhie G, Cho KH, Kim KH, Park KC, Eun HC. Modulation of skin collagen metabolism in aged and photoaged human skin in vivo. The Journal of Investigative Dermatology 117: 1218-1224. 2001.
El-Domyati M, Attia S, Saleh F, Brown D, Birk DE, Gasparro F, Ahmad H, Uitto J. Intrinsic aging vs. photoaging: comparative histopathological immunohistochemical and ultrastructural study of skin. Experimental Dermatology, 11: 398-405. 2002.
Fisher GJ, Datta SC, Talwar HS, Wang ZQ, Varani J, Kang S, Voorhees JJ. Molecular basis of sun-induced premature skin ageing retinoid antagonism. Nature 379: 335-339. 1996.
Han XZ, Gao S, Cheng YN, Sun YZ, Liu W, Tang LL, Ren DM. Protective effect of naringenin-7-O-glucoside against oxidative stress induced by doxorubicin in H9c2 cardiomyocytes. Bioscience Trends 6: 19-25. 2012.
Han X, Ren D, Fan P, Shen T, Lou H. Protective effects of naringenin-7-O-glucoside on doxorubicin-induced apoptosis in H9C2 cells. European Journal of Pharmacology 581: 47-53. 2008.
Itoh K, Masuda M, Naruto S, Murata K, Matsuda H. Effects of unripe Citrus hassaku fruits extract and its flavanone glycosides on blood fluidity. Biological & Pharmaceutical Bulletin 33: 659-664. 2010.
Jung HA, Jung MJ, Kim JY, Chung HY, Choi JS. Inhibitory activity of flavonoids from Prunus davidiana and other flavonoids on total ROS and hydroxyl radical generation. Archives of Pharmacal Research 26: 809-815. 2003.
Kusukawa J, Harada H, Shima I, Sasaguri Y, Kameyama T, Morimatsu M. The significance of epithelial growth factor receptor and matrix metalloproteinase-3 in squamous cell carcinoma of oral cavity. European Journal of Cancer Part B: Oral Oncology 32B: 217-221. 1996.
Lee YR, Noh EM, Han JH, Kim JM, Hwang JK, Hwang BM, Chung EY, Kim BS, Lee SH, Lee SJ, et al. Brazilin inhibits UVB-induced MMP-1/3 expressions and secretions by suppressing the NF-κB pathway in human dermal fibroblasts. European Journal of Pharmacology 674: 80-86. 2012.
Mays PK, Bishop JE, Laurent GJ. Age-related changes in the proportion of type I and III collagen. Mechanisms of Ageing and Development 45: 203-212. 1988.
Na EJ, Yang HO, Choi YE, Han HS, Rhie SJ, Ryu JY. Antiinflammatory and collagen production effect of syringic acid on human keratinocyte (HaCaT) damaged by ultraviolet B. Asian Journal of Beauty and Cosmetology 16: 523-531. 2018.
Perlish JS, Lemlich G, Fleischmajer R. Identification of collagen fibrils in scleroderma skin. The Journal of Investigative Dermatology 90: 48-54. 1998.
Rittié L, Fisher GJ. UV-light-induced signal cascades and skin aging. Ageing Research Reviews 1: 705-720. 2002.
Roshchin YV, Gerashchenko GI. Anti-inflammatory activity of some flavonoids. Vopr Farm Dal’'nem Vostoke 1: 135. 1973.
Saito Y, Shiga A, Yoshida Y, Furuhashi T, Fujita Y, Niki E. Effects of a novel gaseous antioxidative system containing a rosemary extract on the oxidation induced by nitrogen dioxide and ultraviolet radiation. Bioscience Biotechnology, and Biochemisty, 68: 781-786. 2004.
Varani J, Perone P, Fligiel SE, Fisher GJ, Voorhees JJ. Inhibition of type I procollagen production in photodamage: correlation between presence of high molecular weight collagen fragments and reduced procollagen synthesis. Journal of Investigative Dermatology 119: 122-129. 2002.
Wlaschek M, Tantcheva-poór I, Naderi L, Ma W, Schneider LA, Razi-Wolf Z, Schüller J, Scharffetter-Kochanek K. Solar UV irradiation and dermal photoaging. Journal of Photochemistry and Photobiology B 63: 41-51. 2001.
Yoon Y. Gene expression profiling in protection mechanism of silibinin against damage to human dermal fibroblasts caused by UVB. Asian Journal of Beauty and Cosmetology 11: 93-102. 2013.
|
|
|||||||||||||||||||||||||||||||||||