Introduction
최근 의학기술의 발달과 생활수준의 향상으로 인해 수명이 연장됨에 따라 건강뿐만 아니라 미용에 대한 관심도 증가하고 있다. 그리고 전 세계적으로 환경오염, 화학물질 사용 증가 그리고 바이러스 등 외부환경의 변화로 인해 신체의 다양한 변화로 불편함을 겪는 소비자들이 증가하면서 친환경적이고, 안전한 제품을 찾는 기준이 높아지고 있으며(Oh et al., 2010), 최근 소비자의 니즈에 부응하는 천연물 유래의 소재에 대한 기능성을 밝히고 제품에 적용시키기 위한 연구들이 활발히 이루어지고 있다(Bae et al., 2012; Kim & Lee, 2022).
신체에서 피부는 가장 바깥쪽에 위치하며 크게 표피, 진피 그리고 피하지방으로 구성되어 있으며, 표피가 가장 바깥쪽에 위치한다. 표피는 가장 바깥쪽에서부터 각질층, 투명층, 과립층, 유극층 그리고 기저층으로 이루어져 있다. 각질층에 의해 자외선 등 외부 물질에 대한 방어 역할을 하며(Fisher et al., 2002; Kim et al., 2014; Park et al., 2019), 체내 전해질과 수분 등의 손실을 예방하는 역할을 한다(Elias, 1983; Feingold et al., 2007). Melanin은 표피의 가장 아래층과 진피 사이에서 생성되며, 적정 수준으로 존재할 때 자외선으로 부터 세포를 보호하는 역할을 한다. 또 melanin은 생성되는 종류와 양에 따라 눈동자, 피부 그리고 머리카락 등의 색을 결정하는 핵심적인 요인이다(Choi, 2022; Hill et al., 1997). 그러나 melanin의 생성이 과도하거나 비정상적으로 일어나게 되면 피부에서 주근깨, 과색소침착, 피부염 그리고 피부암 등을 발생시킬 수 있다고 알려져 있다(Urabe et al., 1994).
망고(Mangifera indica L.)는 열대 및 아열대 지역에서 주로 재배되고 있으며(Jung et al., 2016), 국내에서 잘 알려진 품종으로는 노란색 망고인 카라바오 망고와 붉은색의 어윈 망고가 대표적이며, 어윈 망고는 껍질이 붉고 당도가 높아 애플망고(Mangifera indica L. Irwin)라 불려 진다. 애플망고는 국내 경상남도를 포함한 남부지역을 비롯해 제주도에서도 재배되고 있다(Go et al., 2010; Jung et al., 2015; Jung et al., 2016). 일반적으로 망고에는 비타민, 무기염류 그리고 아미노산류 등이 포함되어져 있고 여러 종류의 polyphenol 화합물 중 mangiferin이 다량 함유되어 있으며, 약용 및 생리 활성작용으로 활용 가능성이 높고 항당뇨, 항산화, 면역 조절 그리고 소염 등의 다양한 생리 활성을 지니고 있다고 알려져 있다(Han et al., 2016). 그러나 망고는 자가불화합성 품종이 많아서 수정이 되지 않으면 유과기에 낙과가 많이 발생하게 되며, 높은 품질의 과실을 얻어내기 위해 유과기에 적과하여 폐기 처리된다(Lim et al., 2016). 이렇게 폐기처리 되는 애플망고 적과를 활용한 연구는 미비한 실정이다. 재배 과정 중 솎아내어 버려지는 적과는 성숙과에 비해 아미노산, 유기산류, 무기이온 그리고 폴리페놀 함량 등의 여러 성분의 함량이 더 높지만 당 함량이 낮아 가공용으로는 부족하기 때문에 생리활성 물질이나 식이섬유 등을 활용한 기능성 소재로서 사용될 수 있다(Jung et al., 2002).
따라서 본 연구에서는 재배과정 중 버려지는 애플망고 적과를 열수 추출하여 melanin 생성 경로에서 주요한 역할을 하는 효소인 tyrosinase 저해 활성을 평가하였다. 그리고 B16F10 세포에서의 애플망고 적과 추출물인 TME 처리에 의한 미백 활성을 평가하기 위해 세포내 melanin 함량을 분석하고 reverse transcription-polymerase chain reaction (RT-PCR)을 통해 melanin 형성과 연관된 유전자인 tyrosinase, tyrosinase related protein-1 (TRP-1) 그리고 tyrosinase related protein-2 (TRP-2)의 발현 수준에 미치는 영향을 확인하여 천연물 소재로서 애플망고 적과 추출물의 활용가능성을 확인하고자 하였다.
Methods
1. 재료
본 연구에 사용된 애플망고 적과는 이성고농장(Korea)에서 제공받아 사용하였다. Mushroom tyrosinase, L-tyrosine, sodium phosphate monobasic, sodium phosphate dibasic, 3-isobutyl-1-methylxanthine (IBMX), thiazolyl blue tetrazolium bromide (MTT), chloroform, alpha-melanocyte stimulating hormone (α-MSH) 그리고 arbutin은 Sigma-Aldrich Co. (USA)에서 구매하였다. Dimethyl sulfoxide (DMSO)와 isopropanol은 Junsei Chemical Co. (Japan)에서 구매하여 사용하였으며, 94% ethanol, potassium phosphate dibasic anhydrous와 potassium phosphate monobasic은 Daejung Chemicals & Metals Co., Ltd. (Korea)에서 구매하여 실험에 사용하였다. Dulbecco's Modified Eagle's Medium (DMEM), fetal bovine serum (FBS), trypsin-ethylenediaminetetraacetic acid (EDTA), phosphate-buffered saline (PBS) 그리고 penicillin-streptomycin은 WELGENE Inc. (Korea)에서 구매하였다.
2. 애플망고 적과 추출물 제조
세척 후 건조된 애플망고 적과 중량의 10배수의 증류수를 넣고 100±2℃에서 3 h 동안 추출기(MS-DM609; Misung, Korea)를 이용하여 환류 추출한 후 53 μm의 체 필터로 걸러준 다음 50℃에서 감압 농축(OSB02100, RK-1020; KOC Biotech Co., Ltd., Korea) 하였다. 농축 후 진공 동결건조기(LP 20; Ilshinbiobase, Dongducheon, Korea)로 동결건조 하고 -20℃에서 보관 후 추후 실험에 사용하였다. 애플망고 적과 추출물(thinned immature apple mango extract, TME)의 수율(%, w/w)은 추출 전 무게에 대한 동결 건조 후 무게의 백분율로 나타냈을 때 63.13% (w/w-dried Irwin weight)으로 나타냈다.
3. Tyrosinase inhibition activity
애플망고 적과 추출물(thinned immature apple mango extract, TME)의 미백 효과를 알아보기 위해 melanin 형성 과정 중 주요한 효소로 알려진 tyrosinase 저해 활성을 측정하였다. 제조된 TME를 DMSO에 100, 200 그리고 400 μg/mL의 농도로 희석하여 사용하였다. 96-well plate에 농도별 TME를 20 μL와 0.1 M sodium phosphate buffer (pH 6.5) 220 μL 그리고 tyrosinase (100U) 20 μL를 순서대로 첨가하였다. 이 혼합 용액에 1.5 mM L-tyrosine 40 μL를 넣고 37℃의 incubator에서 15 min 동안 반응시킨 후, microplate reader (VersaMax; Molecular Devices, USA)를 이용하여 490 nm에서 흡광도를 측정하였다. 공시료액으로 시료 대신 0.1 M sodium phosphate buffer (pH 6.5)를 넣어 사용하였다. 양성 대조군으로는 미백 활성 소재로 잘 알려진 arbutin을 TME와 같은 농도로 처리하여 비교하였다.
Tyrosinase inhibition activity (%) = (TME 처리군의 흡광도/대조군의 흡광도)×100
4. B16F10 세포배양
본 실험에 사용된 B16F10 세포는 한국세포주은행(Korea Cell Line Bank No. 80008, Korea)에서 분양 받았다. B16F10 세포를 100 mm 세포배양 dish에 10% (v/v)의 fetal bovine serum (FBS)과 1% (v/v)의 penicillin-streptomycin이 포함된 Dulbecco's Modified Eagle Medium (DMEM)을 처리하여 37℃의 5% CO2 배양기에서 배양하였다. 이틀에 한 번 FBS-DMEM을 교체해 주었다.
5. B16F10 세포 독성 평가
TME 처리에 의한 세포 독성을 MTT assay를 통해 평가하였다. Confluent 상태의 B16F10 세포에 10, 50, 100 그리고 200 μg/mL의 농도로 TME를 24 h 동안 처리하였다. 처리 후 PBS에 용해된 2 mg/mL의 MTT 시약을 200 μg/mL로 DMEM 배지에 희석하여 37℃의 5% CO2 배양기에서 1 h 동안 반응시킨 후, 배지를 완전히 제거하고 1,000 μL의 DMSO를 사용하여 보라색의 formazan을 용해시켰다. Formazan 용액은 96-well plate에 100 μL을 넣어 microplate reader (VersaMax; Molecular Devices, USA)를 이용하여 570 nm에서 흡광도를 측정하였으며, 대조군으로는 아무것도 처리되지 않은 B16F10 세포의 흡광도로 세포독성(% of control)을 평가하였다.
6. Melanin contents
B16F10 세포에서 TME 처리에 의한 melanin 형성 억제 활성을 평가하여 미백 기능성을 확인하였다. TME를 각각 10, 50 그리고 100 μg/mL 농도로 처리하고 1 mM의 IBMX와 1 μM의 α-MSH을 96 h 동안 함께 처리하여 melanin 생성을 유도하였다. 96 h의 처리가 끝난 후 세포가 자란 DMEM을 96-well plate에 160 μL를 넣어 microplate reader (VersaMax; Molecular Devices, USA)를 이용하여 405 nm에서 세포 외 melanin 함량을 측정하였다. 12-well plate에서 trypsin-EDTA 200 μL를 사용하여 세포를 떼어내 tube에 넣고 상온에서 1,008 RCF으로 5 min 동안 원심분리하였다. 그리고 DMEM을 완전히 제거하고 가라앉은 melanin pellet에 1N NaOH와 DMSO를 섞은 용액을 400 μL 첨가한 후, 교반하여 100℃의 heating block (Taitec Co., Ltd., Japan)에서 10 min 동안 가열하였다. 그 다음 96-well plate에 160 μL을 분주하여 microplate reader (VersaMax; Molecular Devices, USA)를 이용하여 405 nm에서 세포 내 melanin 함량의 흡광도를 측정하였다. Melanin 형성을 유도하지 않은 대조군을 (-)control, melanin 형성을 유도하고 TME를 처리하지 않은 대조군을 (+)control로 표시하였다. (+)control의 흡광도를 대조군으로 하여 세포 내 melanin 함량(% of (+)control)을 측정하였다.
7. RT-PCR을 통한 mRNA 발현 수준 분석
TME의 처리가 B16F10 세포에서 melanin 형성에 어떠한 영향을 끼치는지 확인하기 위해 RT-PCR을 통한 mRNA 발현 수준을 분석하였다. TME를 50 그리고 100 μg/mL 농도로 처리하고 1 mM의 IBMX와 1 μM의 α-MSH를 함께 96 h 동안 처리하여 melanin 분화를 유도하였다. 96 h의 처리가 끝난 후 TRIzolⓇ을 이용하여 total RNA를 추출하였다. TRIzolⓇ 추출물에 chloroform 100 μL를 넣은 뒤 15 s 동안 혼합하여 12,000 relative centrifugal force (RCF)에서 15 min 동안 원심분리한 후 상층액을 획득하였다. 획득한 상층액에 250 μL의 isopropanol을 넣고 혼합한 다음 10 min 동안 상온에 방치하고 원심분리기를 이용하여 12,000 RCF에서 10 min 동안 RNA를 분리하였다. CycleScript RT PreMix을 이용하여 분리된 RNA는 정량한 뒤 cDNA를 합성하였다. 또한 thermal cycler (T100; Bio-Rad, USA)를 이용하여 합성된 cDNA는 RT-PCR을 수행한 후 mRNA 유전자 발현 수준을 알아보기 위해 2% (w/v)의 agarose gel에 35 min 동안 100V의 조건에서 전기영동을 실시하여 mRNA 발현 수준을 분석하였다. 본 실험에 사용된 primer sequences는 Table 1과 같다.
Results and Discussion
1. Tyrosinase inhibition activity
Melanin 생성 경로 중 중요한 역할을 하는 효소 중 하나인 tyrosinase는 페놀 화합물 중 tyrosine을 기질로 이용하는 효소이다(Lerner & Fitzpatrick, 1950). Tyrosine은 tyrosinase에 의하여 L-3,4-dihydroxyl-L-phenylalanine (L-DOPA)로, L-DOPA는 dopaquinone으로 산화되어, 이는 다시 5,6-dihydroxyindole 또는 indole 5,6-quinone으로 산화되어 최종적으로 melanin이 합성된다(Chang et al., 2013). 이러한 melanin의 생성이 과도할 경우, 주근깨, 기미, 검버섯, 피부 노화 촉진 및 피부암 등을 유발할 수 있다(Bell & Weeler, 1986). 따라서 과도한 melanin의 생성을 막기위해 tyrosinase 효소 활성을 저해할 수 있는 물질에 대한 연구가 활발히 이루어지고 있는데, 대표적으로 ascorbic acid, kojic acid 그리고 arbutin 등이 있으나 천연물 유래의 tyrosinase 효소 활성 저해제에 관한 연구는 미비한 실정이다. 따라서 본 연구에서는 melanin 생성 경로 중 중요한 역할을 하는 효소 중 하나인 tyrosinase를 이용하여 TME의 처리가 tyrosinase의 활성을 억제하여 melanin 생성 경로를 저해하는 실험을 하였다. 그 결과 TME를 100, 200 그리고 400 μg/mL로 처리하였을 때 각각 대조군 대비 12.06%, 17.04% 그리고 13.88%의 저해 활성을 나타냈다. 양성 대조군으로 사용한 arbutin은 TME와 같은 농도인 100, 200 그리고 400 μg/mL로 처리하였을 때 28.19%, 52.96% 그리고 94.59%의 melanin 생성 저해 활성을 나타냈다(Figure 1). Kim et al. (2022)의 애플망고 껍질 열수 추출물의 tyrosinase 저해 활성 측정 결과 1,000 μg/mL에서 9.51%의 tyrosinase 저해활성을 나타냈다. TME의 처리는 melanin 생성에 주요한 역할을 하는 효소인 tyrosinase의 활성을 보다 효과적으로 저해하였음으로 추후 세포 모델을 활용한 실험이나 더 나아가 in vivo/ex vivo 실험의 선행 연구로서의 역할을 하는 결과라 생각된다.
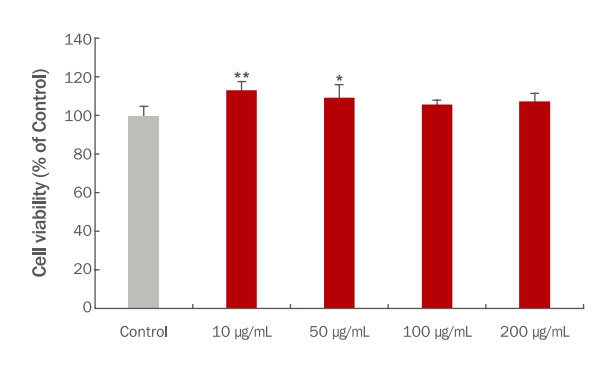
2. TME 처리에 의한 B16F10 세포의 생존율 확인
B16F10 세포에서 TME 처리에 의한 농도별 세포 생존율을 확인하기 위해 MTT assay를 실시하였다. TME를 B16F10 세포에 각각 10, 50, 100 그리고 200 μg/mL 농도로 24 h 동안 처리한 결과 각각 108.68%, 107.99%, 97.80% 그리고 102.17%로 모든 농도에서 95% 이상의 세포 생존율을 나타냈다(Figure 2). 따라서 추후 실험에서는 10, 50 그리고 100 μg/mL의 농도로 실험을 진행하였다.
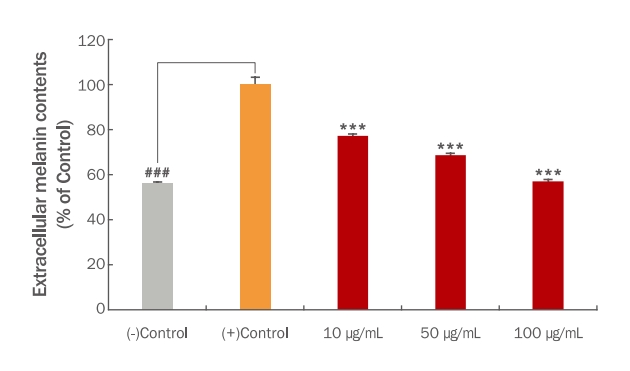
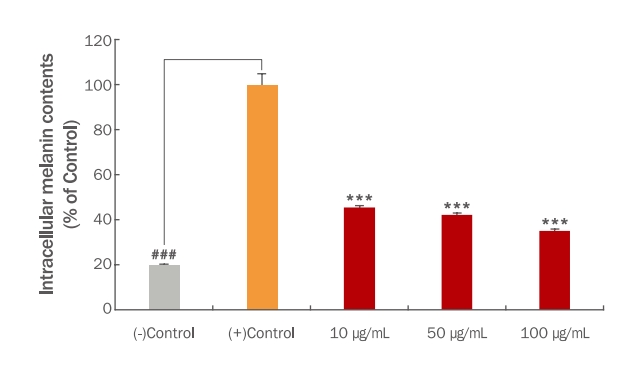
3. TME 처리에 의한 melanin 형성 억제 활성 평가
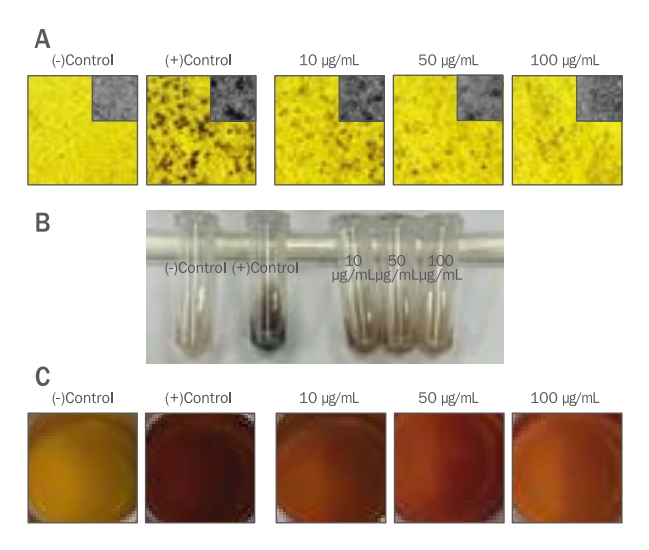
TME를 처리하였을 때 B16F10 세포에서의 melanin 형성에 어떤 영향이 있는지 알아보기 위해 실험을 진행하였다. B16F10 세포가 70% confluent 상태가 되면 melanin 형성을 유도하기 위해 1 mM IBMX와 1 μM α-MSH를 96 h 처리하고 같은 시간 동안 TME를 각각 10, 50 그리고 100 μg/mL의 농도로 처리하였다. 1 mM IBMX와 1 μM α-MSH로 melanin 형성을 유도하지 않은 (-)control 대비 melanin 형성을 유도한 (+)control은 (-)control과 비교하여 많은 양의 melanin이 형성된 것을 관찰하였다. B16F10 세포 외 melanin의 함량은 TME를 10, 50 그리고 100 μg/mL로 처리하였을 때 대조군 대비 77.26%, 68.68% 그리고 57.11%로 나타났으며(Figure 3), B16F10 세포 내에 축적된 melanin의 함량은 TME를 10, 50 그리고 100 μg/mL로 처리하였을 때 대조군 대비 45.32%, 42.22% 그리고 35.06%로 나타났다(Figure 4). 또한, B16F10 세포에 축적된 melanin의 양을 이미지로 정성 분석하였을 때 위의 정량 결과와 유사한 결과를 나타냈다. Melanin 형성을 유도한 (+)control 대비 TME를 처리한 군에서는 농도 의존적으로 melanin 형성량이 감소된 것을 색변화로 관찰할 수 있었다(Figure 5). Yoo & Lee (2021)의 연구에서는 애플망고 적과를 70% 에탄올로 추출하여 B16F10 세포에서 melanin 생합성 저해능을 측정하였을 때 70% 에탄올 추출물 보다는 열수 추출을 한 애플망고 적과의 melanin 생합성 저해능이 높다고 사료되며 이는 추출용매에 따른 애플망고 적과의 활성 성분에 따른 차이라 생각할 수 있다. 이러한 결과를 통해 재배과정 중 버려지는 애플망고 적과를 활용하여 미백 기능의 고부가가치화 할 수 있는 화장품 및 식품의 천연소재로서의 가능성을 시사한다. 그리고 추후 LC/MS 및 GC/MS 등을 이용하여 정확한 성분을 분석하여 생리활성 물질을 탐색해내는 연구가 더 필요하다고 생각된다.
4. TME 처리가 B16F10 세포의 tyrosinase, TRP-1 그리고 TRP-2 발현에 미치는 영향
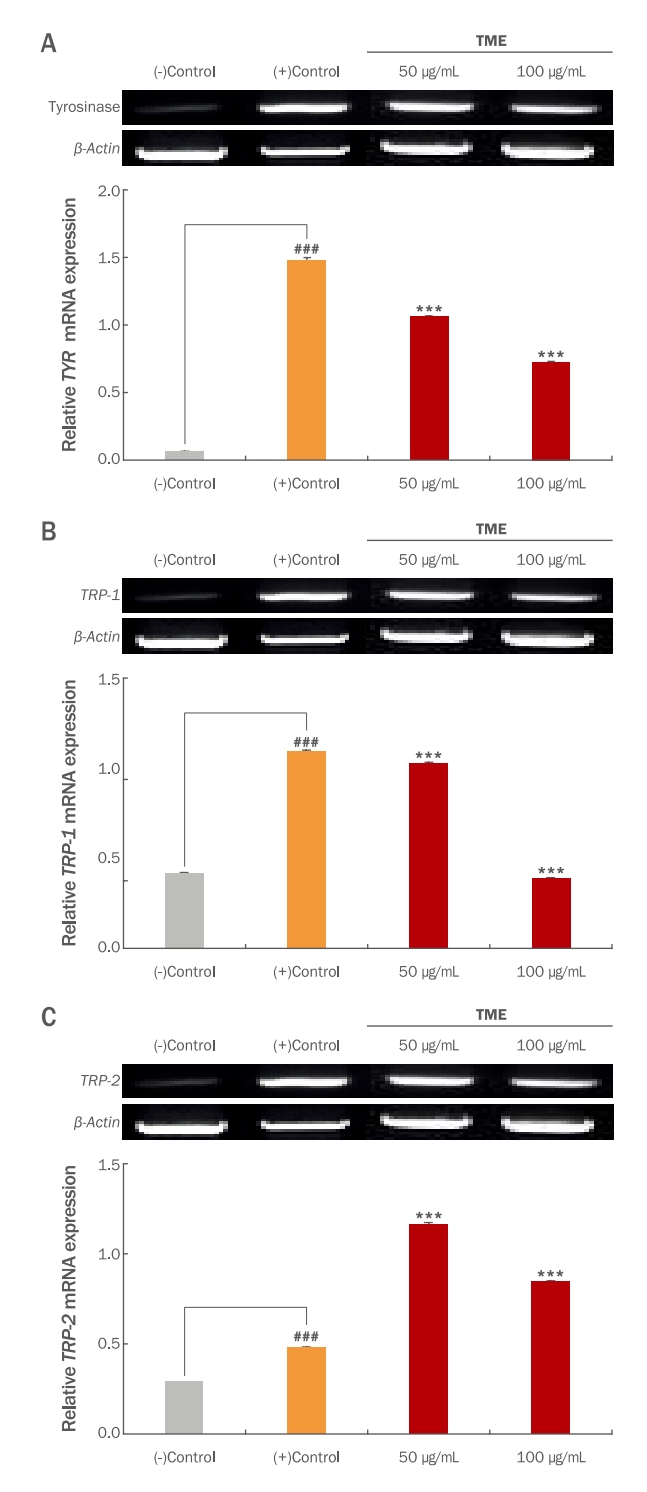
생체 내에 melanin 생성과 관련된 효소로는 tyrosinase, tyrosinase related protein-1 (TRP-1), tyrosinase related prote in-2 (TRP-2) 등이 있다. TRP-1과 TRP-2는 5,6-dihydroxyindole-2-carboxylic acid (DHICA)를 흑갈색으로 나타내는 indole-5,6-quinone-2-carboxylic acid로 전환시켜 최종적으로 melanin을 합성하고, tyrosinase는 melanin을 생성하는 효소로서 tyrosine, DOPA oxidase 그리고 hydroxylase의 활성을 나타내며, melanocyte 세포 내에서 tyrosinase, TRP-1 그리고 TRP-2 등의 유전자 발현이 증가하면 melanin 생성이 증가하게 된다. 따라서 tyrosinase 발현을 억제하면 melanin 생성을 억제할 수 있다. Melanin의 생성을 억제하는 경로와 생성된 melanin을 분해 촉진하는 효소의 활성 조절이 중요하게 알려져 있어 미백 관련 신호전달인자의 측정은 미백 효능을 검증하는데 유용한 방법으로 사용되고 있다(Kim et al., 2010; Mallick et al., 2005; Oh et al., 2007). 본 연구에서는 TME 처리가 B16F10 세포에서 tyrosinase, TRP-1 그리고 TRP-2의 mRNA 발현에 어떠한 영향을 미치는지 알아보기 위해 RT-PCR을 진행하였다. B16F10 세포에 TME를 50 그리고 100 μg/mL 농도로 처리하고 1 mM의 IBMX와 1 μM의 α-MSH를 함께 96 h 동안 처리하여 melanin 분화를 유도한 다음 RT-PCR을 통해 각각의 유전자 발현 정도를 분석하였다. 그 결과 TME의 처리가 B16F10 세포에서 melanin 생성에 관여하는 유전자인 tyrosinase는 (+)control에 비해 50 그리고 100 μg/mL에서 28.3% 그리고 51%로 발현을 감소시켰으며, 뿐만 아니라 TRP-1의 발현은 (+)control에 비해 50 그리고 100 μg/mL에서 6% 그리고 64.4%의 발현을 유의한 수준으로 감소시켰으며 이러한 결과는 mRNA 수준에서 melanin생성을 저해하는 것으로 확인되었다(Figure 6). 부산물인 애플망고 껍질 추출물의 melanin 생성관련 유전자 발현수준을 비교하였을 때 TME와 마찬가지로 tyrosinase의 발현 수준을 농도 의존적으로 감소시켰다(Kim et al., 2022). 따라서 본 연구 결과를 통해 TME의 처리가 melanin 생성에서 주요한 역할을 하는 tyrosinase의 발현을 유전자 수준에서 감소시켜 천연물질을 이용한 미백 관련 소재로서의 활용 가능성이 있는 것으로 판단된다. 그러나 애플망고 적과를 활용한 미백 기전을 밝히는 연구는 매우 부족한 실정이다. 따라서 더 나아가 TME에 의한 미백 기능을 평가하기 위해 in vivo 동물모델에서 피부 미백 기전에 미치는 영향 등은 추후 연구를 통해 확인되어야 할 것으로 생각된다.
Conclusion
최근 국내 기후 변화로 인해 경상남도를 포함한 남부지역에서는 대표적인 열대 과일인 애플망고의 재배가 활발히 이루어지고 있으며 이에 따라 소비자들의 수요가 증가하고 있다. 그러나 재배 과정 중 버려지는 애플망고의 적과는 활용도가 낮아 폐기되고 있는 실정이다. 이에 본 연구에서는 부산물로서 폐기되는 애플망고 적과를 활용하기 위해 천연물 유래의 미백 기능성 탐색을 실시하였다. 애플망고 적과 추출물(TME)을 in vitro 모델에서 tyrosinase 저해 활성을 평가하였을 때 미백 활성을 나타냈으며, TME 처리에 의한 B16F10 세포에서의 melanin 형성량을 측정한 결과 농도 의존적으로 세포 내외 melanin 형성을 저해하였다. 이러한 결과를 바탕으로 TME 처리에 의한 melanin 형성 저해 활성을 melanogenic 관련 유전자인 tyrosinase, TRP-1 그리고 TRP-2의 발현수준을 RT-PCR을 통해 평가하였을 때 TME의 처리 농도에 따라 tyrosinase의 발현 수준은 감소하였다. 따라서 TME의 처리에 의한 melanin 형성이 저해되었으며 이러한 결과는 애플망고 적과의 미백 기능성 원료로서의 가능성을 확인하였다.