요약방법CBD의 정량 분석은 액체크로마토그래피 분석을 통해 수행되었다. CBD의 항염증 평가는 LPS로 유도된 Raw 264.7 세포에서 NO 함량을 측정하였다. CBD 첨가 크림의 항염증 평가는 SDS로 유도된 keraskinTM 모델에서 IL-1α 함량을 측정하였다. CBD 및 CBD 첨가 크림의 세포독성은 각 세포 모델에서 MTT assay를 이용하여 수행하였다.
AbstractPurposeThis study evaluated the anti-inflammatory properties of a cannabidiol (CBD) extract obtained by supercritical fluid extraction (SFE) from Cannabis sativa L. and a cream containing the extract.
MethodsThe CBD extract was quantitatively analyzed using high-performance liquid chromatography. We used a lipopolysaccharide (LPS)-induced RAW 264.7 cell model of inflammation to determine the anti-inflammatory effect of the CBD extract by measuring nitric oxide (NO) production. We evaluated the anti-inflammatory properties of a cream containing the CBD extract by measuring interleukin-1 alpha (IL-1α) levels induced by sodium dodecyl sulfate (SDS) in KeraSkinTM, a human skin model. The cytotoxicity of the CBD and CBD-containing cream was assessed by MTT assay in each model.
ResultsThe average purity of the CBD extracted and refined by SFE was 99.40%. The CBD extract and CBD cream showed concentration-dependent inhibition of inflammation. At 4 μg/mL, NO production in the RAW 264.7 cell model was significantly decreased by 64.98% compared with the negative control. IL-1α production induced by SDS in the KeraSkinTM model decreased by 54.17% in the group treated with cream containing 0.4% CBD compared with the negative control and 22.09% compared with the positive control groups.
中文摘要方法采用高效液相色谱法对CBD提取物进行定量分析。我们使用脂多糖 (LPS) 诱导的 RAW 264.7 炎症细胞模型,通过测量一氧化氮 (NO) 的产生来确定 CBD 提取物的抗炎作用。我们通过测量人体皮肤模型 KeraSkinTM 中十二烷基硫酸钠 (SDS) 诱导的白细胞介素 1 α (IL-1α) 水平,评估了含有 CBD 提取物的乳霜的抗炎特性。在每个模型中通过 MTT 测定评估 CBD 和含 CBD 霜的细胞毒性。
Introduction대마(Cannabis sativa L.)는 인류가 재배한 오래된 식물 중 하나로 섬유, 식품, 바이오연료, 의약품 및 약물을 포함한 다양한 용도로 활용되어 왔다. 주요 성분으로는 칸나비디올(cannabidiol, CBD), 테트라하이드로칸나비놀(tetrahydrocannabinol, THC), 칸나비크로멘(cannabichromene, CBC), 칸나비게롤(cannabigerol, CBG), 칸나비놀(cannabinol, CBN)을 포함한 칸나비노이드(cannabinoid) 성분이다(Figure 1). 대마의 분류는 향정신성 물질인 Δ9-THC 함량이 0.3% 이하인 경우 헴프(Hemp), 0.3% 초과인 경우 마리화나(Marijuana)라고 정의하였다(Valizadehderakhshan et al., 2021). 칸나비노이드 중 환각작용이 없고 통증 완화, 구토, 항염증 등 많은 의학적 효능이 있다고 알려져 있는 CBD는 의료 목적으로 활용하기 위해 전 세계적으로 많은 연구가 진행되고 있다(Mechoulam et al., 2002; Mechoulam et al., 2007; Burstein, 2015; Sangiovanni et al., 2019; Zi et al., 2022). 대마로부터 CBD를 포함하여 칸나비노이드를 추출하는 방법 중 이산화탄소를 이용한 초임계유체 추출방법(supercritical fluid extraction, SFE)은 기존의 유기용매 기반 추출 방법에 비해 선택적 추출, 짧은 시간, 낮은 운영 비용 및 환경 친화적인 강점이 있어 점점 더 많은 관심을 받고 있다(Qamar et al., 2021).
피부는 크게 표피와 진피로 구성되어 있으며, 다양한 외적 및 내적 물리적 자극에 반응한다(Jang, 2018). 표피세포는 피부 장벽을 형성하는 각질형성세포, 멜라닌을 형성하여 자외선을 막아주는 멜라닌세포, 면역기전을 담당하는 랑게르한스세포로 구분된다. 진피는 대부분의 세포외 기질을 함유하고 있으며, 혈관, 섬유아세포를 포함한 다른 세포 상처치유에 관여한다. 각질형성세포는 피부 장벽 형성 기능 이외에도 interleukin (IL)-1α, IL-6, IL-8와 같은 사이토카인을 조절하는 기능이 있다(Ansel et al., 1990). 피부 염증반응은 물리적, 화학적, 세균감염 등 어떠한 외부 자극을 받아 손상되었을 때 회복하는 기전이다. 그러나 과도한 염증반응은 오히려 피부 트러블을 유발하고, 가려움, 물집 등 피부질환을 유발한다.
마우스로부터 유래한 대식세포 Raw 264.7 세포는 면역 항상성 유지에 관여하며, 염증반응 시에 nitric oxide (NO)와 tumer necrosis factor-α (TNF-α), IL-6 등의 사이토카인을 생산하여 초기 감염 방어에 중요한 역할을 한다(Hwang et al., 2014; Dong et al., 2017; Yang et al., 2010; Kim et al., 2023). 그러나 이들의 과다한 활성에 의한 과잉 생산으로 오히려 염증이 심화되어 인체에 유해한 방향으로 진행될 수 있다. 따라서 이를 제어하는 것은 만성염증 질환 및 알레르기 질환의 예방과 치료에 유의미하게 작용할 수 있다.
현재 CBD는 SFE를 비롯한 다양한 기술을 활용하여 생산되고 있으며, 그 의학적 효능이 뛰어남에 따라 연구가 활발히 진행 중이다(Herrero et al., 2010; Qamar et al., 2021; Rochfort et al., 2020; Marzorati et al., 2020). 특히 epidiolex와 sativex는 널리 알려진 CBD 기반의 약물로서 뇌전증 및 다발성경화증 질환에 대한 치료 목적으로 이용되고 있다(Devinsky et al., 2018; Giacoppo et al., 2017). 반면 의료 목적 외 활용방안에 대해서는 연구가 미흡하며, 특히 국내에서는 아직까지 CBD에 대한 마약류 관리법의 법적 규제로 인해 연구 및 활용이 어려운 상황이다. 따라서 본 연구에서는 CBD 소재의 활용 가능성을 높이기 위해 항염증 소재로써 가능성을 확인하고자 하였으며, 이를 통한 대마로부터 추출한 CBD의 사회적 인식 개선 및 법적 규제 완화에 기여하고자 한다.
Methods1. SFE를 이용한 CBD 제조 방법본 연구에 사용된 대마는 경북산업용헴프규제자유특구 산업용 헴프 재배 실증을 통해재배된 것으로 수확 후 55℃에서 24시간 동안 건조한 대마의 꽃과 잎이 혼합된 부위를 실증 재배 사업자로부터 제공받아 사용하였다. 제공받은 대마는 연구에 사용하기 전 건조된 대마 1g에 10배수의 에탄올을 첨가하고 초음파를 이용하여 3시간 추출한 후 HPLC로 CBD 및 THC 함량을 분석하여 THC 0.3% (w/w) 미만인 것을 확인 후 사용하였다. 건조된 대마는 분쇄, 탈카르복실화, SFE, 탈왁스, 정제 및 결정화 공정을 통해 CBD를 제조하였다. 먼저 건조된 대마는 분쇄기(Pulverisette 19; Fritsch, Germany)를 사용하여 분쇄하였고, 분쇄된 대마는 120℃에서 탈카르복실화 공정을 통해 칸나비디올릭산(cannabidiolic acid)을 CBD로 전환하였다. 탈카르복실화 된 대마 분말 2 kg을 추출조에 넣고, SFE 장비(SFE-CO2-10L-50M-60 C-R; Phos-Entech, Korea)를 이용하여 추출하였으며, 추출조 온도 50℃, 압력 200 bar로 추출하였다. SFE 추출물의 왁스를 제거하기 위해 추출물에 에탄올(Daejung chemicals & metals, Korea)을 가하여 충분히 용해시키고, 냉동 조건에서 동결한 후 여과하여 왁스를 제거하였다. 여과된 시료는 회전식 증발농축기(Buchi rotavapor R-300; Buchi labortechnik AG, Switzerland)를 이용하여 용매를 제거하였다. 탈왁스 된 시료에 일배수의 에탄올을 첨가하여, 충분히 용해시킨 후 flash chromatography (Puriflash® 535-XL; Interchim, France)에 cannabis purification high quality f1600 flash column (Interchim, France)을 사용하여 정제하였으며, 정제된 시료는 회전식 증발농축기를 이용하여 용매를 제거하였다. Flash chromatography로 정제된 시료는 CBD를 결정화하기 위해 결정화 반응기(Reactor-Ready Lab Reactor; Radleys, England) 의 huber pilot one program을 이용하였고, 시료에 n-pentane (Duksan pure chemicals, Korea)을 가하고 온도를 서서히 낮춰주며 결정화를 진행하였다. 결정화된 CBD는 n-pentane으로 세척 후 건조과정을 통해 잔류용매를 제거하고 실험에 사용하였다.
2. HPLC를 이용한 CBD 함량 분석CBD의 정량분석은 HPLC를 이용하여 수행되었다(Gul et al., 2015; Yu et al., 2022). 칼럼은 Luna C18 (2) column 150×4.60 mm id, 3 µm particle size (Phenomenex, USA)을 사용하였고, 칼럼 온도는 28℃를 유지, 유속은 1.2 mL/min, 시료는 10 μL로 주입하였다. 시료 성분의 검출은 diode array detector를 사용하여 220 nm에서 분석하였다. 이동상 A는 0.1% 포름산 수용액, 이동상 B는 0.1% 포름산 함유 아세토나이트릴을 사용하였고, Table 1에 제시된 기울기 용리 조건으로 분석하였다. CBD (Cayman chemical, USA) 및 THC (Cayman chemical)의 표준용액을 활용한 검량곡선으로 표준 검량선을 작성 후, 시료의 크로마토그램을 통해 정량하였다(Figure 2).
3. Raw 264.7 세포를 이용한 세포 독성 및 NO 억제 효능 측정Raw 264.7 세포는 american type culture collection (ATCC; USA)에서 구입하여 10% fetal bovine serum (FBS; Gibco, USA) 와 1% penicillin/streptomycin (Gibco)이 함유된 dulbelcco's modified eagles medium (DMEM; Gibco, USA) 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다. 이후 trypsin-EDTA와 phosphate buffered saline (PBS; Gibco)를 이용하여 계대 배양하여 실험을 수행하였다.
세포 독성 시험은 3-(4,5-dimethyl-thiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay (Mosmann, 1983)를 이용하여 측정하였다. Raw 264.7 세포를 96 well plate에 1×105 cells/well로 접종하여 24시간 배양한 다음 serum이 포함되지 않은 DMEM 배지로 교환하였으며, 시료를 처리한 후 24시간 배양하였다. 배양 후 각 well에 5 mg/mL의 MTT용액을 10 μL씩 분주한 후 3시간 동안 환원 반응을 유도하였다. 이후 상등액을 제거하고 100 μL dimethyl sulfoxide (DMSO; Sigma-Aldrich, USA) 용액을 첨가하여 보라색의 formazan 결정을 완전히 용해하여 발색 정도를 분광광도계(Multiskan SkyHigh; Thermo Scientific, USA)를 이용하여 570 nm에서 흡광도를 측정하였으며, 무처리군 대비 백분율로 나타내었다.
NO 함량은 griess reagent (Sigma-Aldrich)를 이용하여 측정하였다. Raw 264.7 세포를 96 well plate에 1×105 cells/well로 접종하여 24시간 배양한 다음, serum이 포함되지 않은 DMEM 배지로 교환하였으며, 동시에 시료를 처리하였다. 1시간 후 1 μL/mL의 lipopolysaccharides from Escherichia coli O111:B4 (LPS; Sigma-Aldrich)를 처리한 후 20시간 배양하였다. 배양 후 상등액과 동량의 griess 시약을 10분간 반응시킨 후 분광광도계를 이용하여 540 nm에서 측정하였으며, LPS 단독처리군 대비 백분율로 나타내었다.
4. CBD 첨가 크림 제조세포독성 및 유효성 평가를 위해 제조된 크림의 혼합 비율은 Table 2와 같다. 부형제에 의한 in vitro 시험 오차를 최소화하기 위해 최소 한의 원료 및 배합비로 크림을 제조하였다. 온도에 의한 CBD의 변질을 최소화하기 위해 CBD는 카프릴릭/카프릭트리글리세라이드(Myritol 318; Basf, Germany) 2%를 용매로 하여 70℃ 항온조에서 녹인 후 투입하였다. CBD 함량별 세포독성 및 유효성 평가를 위하여, CBD 0.1%, 0.4%, 0.7% 함량별 크림을 각각 제조하였다. 온도 및 저장 보관 조건에 따른 역가감소를 최소화하기 위해 제조 직후 냉동 보관하였다. 대조군은 동일한 혼합 비율에서 CBD를 투입하지 않고 제조되었다(Yu et al., 2022; Franco et al., 2022).
5. Keraskin TM 을 이용한 세포 독성 측정 및 사이토카인 측정Keraskin TM 은 (주)바이오솔루션(Korea)에서 구입하였으며, 업체에서 제공한 assay media를 이용하여 37℃, 5% CO2 조건에서 배양 후 실험에 사용하였다.
세포 수령 이후 육안 검사를 통해 이상 유무를 확인하였으며, 이후 6 well plate에 assay media 900 μL를 각 well에 분주 후 인서트를 로딩하여 24시간 동안 배양하였다. 배양 후 각 인서트를 PBS로 세척하였으며, 동량의 새로운 assay media에 로딩하였다. 이후 0.5% sodium dodecyl sulfate (SDS; Sigma-Aldrich)를 이용하여 염증 유발 및 세포 사멸을 유도하였으며, 동시에 각 농도별 시료를 처리하였다.
세포 독성은 MTT assay를 이용하여 측정하였다. 배양 후 PBS를 이용하여 인서트를 세척하여 0.4 mg/mL MTT 용액 200 μL가 분주된 24 well plate로 옮겼다. 이후 인서트 내부에 동일 농도의 MTT 용액 100 μL 분주 후 3시간 동안 환원 반응을 유도하였다. 이후 상등액을 제거하고 100 μL의 isopropyl alcohol (IPA; Sigma-Aldrich)를 첨가하여 보라색의 formazan 결정을 완전히 용해하고 발색 정도를 분광광도계를 이용하여 570 nm에서 흡광도를 측정하였으며, 무처리군 대비 백분율로 나타내었다.
전염증성 사이토카인인 IL-1 α 의 측정은 시료 처리 후 배양한 배양액을 수거하여 측정하였으며, R&D systems (USA)의 ELISA kit를 이용하여 제조사의 지침에 따라 측정하였다.
Results and Discussion1. CBD 함량 평가건조된 대마 및 제조된 CBD는 HPLC를 이용하여 함량을 평가하였다. CBD 표준용액을 0, 5, 10, 20, 50, 100 μg/mL의 농도로 제조하여 검량선을 작성하였다. 시료에 함유된 CBD 함량은 작성된 검량선을 이용하여 정량하였고, 계산식은 식1)에 나타내었다.
CBD의 함량(%)=[검액 중 CBD의 농도(μg/mL)×검액의 전량(mL)×표준품순도(%)×1000]/검체량(mg)
2. Raw 264.7 세포에서 세포 독성 및 NO 생성 억제 효능 평가CBD의 항염증 효능 확인 및 항염증 소재로 널리 알려진 시판 원료와 비교를 위해 세포 수준에서 실험을 수행하였다. 실험 결과, 각 농도에 대해 무처리군 대비 세포독성을 나타내지 않았고(Figure 3A), 대조군인 LPS 단독 처리군에 비하여 모든 CBD 처리군은 유의적으로 (p<0.001) NO 생성을 억제하는 효과를 나타내었다. 또한 CBD 처리군은 농도의존적으로 감소하는 결과를 나타내었고, 특히 CBD 4 μg/mL 농도 처리군에서는 LPS 단독처리군 대비 64.98% 감소한 수치를 확인하였다(Figure 3B). 추가적으로 기존 시판 항염증 원료와 비교하기 위해 titrated extract of Centella asiatica (TECA; Guangxi changzhou natural pharmaceutical, China), madecassoside (MA;Guangxi changzhou natural pharmaceutical, China), D-panthenol (DSM, England)에 대한 효능 평가를 수행하였다. 본 실험은 각 원료에 대해 독성을 나타내지 않는 최대 농도를 설정한 후 실험에 사용하였다(Figure 3C). 실험 결과, 기존 시판 항염증 원료에서는 대조군인 LPS 단독처리군에 비하여 18.9, 20.0, 19.7%로 미약한 활성을 나타내었으나, CBD 4 μg/mL 처리군에서는 NO 생성을 65.0%, 유의하게 감소시키는 결과를 나타내었다(p<0.001) (Figure 3D). 이러한 결과는 기존 원료 대비 CBD의 높은 항염증 활성을 나타내었으며, 우수한 항염증 소재로써 활용 가능성을 시사한다.
기존 연구에 따르면 CBD는 LPS로 유도된 대식세포에서 nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB) 활성 억제 및 monocyte chemoattractant protein-1 (MCP-1) 수준을 감소시켰으며, 이를 통한 염증 억제 효과를 나타낸 바 있다(Muthumalage & Rahman, 2019). 이러한 결과는 본 실험 결과와 일치하는 경향으로 판단되며, 이를 통한 항염증 효과를 기대할 수 있을 것으로 사료된다.
3. KeraskinTM을 이용한 세포독성 및 사이토카인 측정인공피부는 3차원적으로 인간의 각질형성세포를 재구성한 것으로 피부 자극, 항염증 평가 등의 동물대체시험법에서 사용되고 있다. 국내에서 개발된 keraskinTM은 배양 시 인체 표피와 동일한 상피세포 다층구조의 형성이 뚜렷하고, 전염증성 사이토카인 중 하나인 IL-1α가 발현되고 있음이 보고되었다(Jo et al., 2013). 따라서 피부 자극 시험, 항염증 효능 평가, 피부 질병 모델 등을 평가 예측하는데 활용될 수 있는 표피모델이다(Han et al., 2020).
KeraskinTM을 이용하여 CBD 첨가 크림 제조 후 각 농도에 따른 염증 반응 억제 효능을 평가하였다(Figure 4). 항염증 효능 지표로는 전염증성 사이토카인으로 알려진 IL-1α를 측정하였으며, 동시에 세포 독성 평가를 수행하였다. 대조군인 SDS 단독처리군에 비하여, 양성대조군 및 CBD 첨가 처리군에서는 모두 유의적으로(p<0.05, p<0.01, p<0.001) IL-1 α 를 감소하여 염증 억제 효능을 나타내었다. 특히 CBD 0.4% 첨가한 크림 처리군에서는 SDS 단독처리군 대비 54.17% 감소하였으며, 양성대조군인 비판텐 연고(Bepanthen Ointmemt) 대비 22.09% 감소하여 우수한 항염증 효능을 나타내었다. 동시에 진행한 세포독성 실험에서는 CBD 0.4% 첨가 크림 처리군까지 독성을 나타내지 않았다. 이러한 결과는 양성대조군으로 사용한 비판텐 연고 대비 CBD 첨가 크림의 우수한 항염증 효능을 시사한다.
Conclusion국내산 대마로부터 SFE 및 분리 정제하여 얻어진 CBD의 항염증 효능 및 세포독성을 확인하였다. CBD의 함량은 HPLC를 이용한 분석을 통해 99% 이상임을 확인하였다. 이후 Raw 264.7 세포를 이용하여 세포독성 및 NO 생성 억제능을 평가하였으며, 항염증 효과가 있는 것으로 널리 알려진 TECA, madecassoside 및 D-panthenol과 비교하였다. 실험 결과 비교 군으로 사용된 기존 항염증 소재 대비 CBD가 가장 높은 NO 생성 억제 효과로 우수한 항염증 소재로써 가능성을 제시하였다. CBD 0.1%, 0.4%, 0.7% 첨가 크림을 제조한 뒤, 국내에서 개발된 동물대체시험법인 keraskin TM 을 활용하여 세포독성 및 사이토카인 억제 효능 평가를 수행하였다. 실험 결과 양성대조군으로 사용된 비판텐 연고 대비 CBD 0.4% 첨가 크림에서 우수한 효과를 나타내었다. 이러한 결과를 통해 CBD의 우수한 항염증 소재로써 활용 가능성을 확인할 수 있었다.
현재 국내에서 CBD는 의료 목적으로 많은 연구가 이뤄지고 있으며, 본 연구 또한 CBD의 우수한 항염증 효능을 확인하였으며, 이를 이용한 크림 제형으로써 활용 가능성을 제시하였다. 이는 향후 추가적인 연구를 통해 안전성 및 효능을 입증한다면 기존 항염증 소재를 대체하여 활용이 가능할 것으로 생각되며, 이를 통해 대마로부터 추출한 CBD의 활용 증대 및 사회적인 인식개선에 기여하길 바란다.
Acknowledgements본 연구는 중소벤처기업부의 규제자유특구혁신사업육성 지원(과제번호: P0016082)에 의한 연구임.
본 연구는 중소벤처기업부의 규제자유특구혁신사업육선 지원(과제번호: P0016078)에 의한 연구임.
본 연구는 중소벤처기업부의 규제자유특구혁신사업육성 지원(과제번호: P0023712)에 의한 연구임.
NOTESAuthor's contribution
SYK, HLK and SMA made a CBD. SYK conducted evaluation of anti-inflammation of CBD and CBD-containing cream. HLK performed evaluation of CBD contents by HPLC. SDY made a CBD-containing cream. ARS and KJS assisted with experimental design. IBP and JSK oversaw the project. HJP contributed to all aspects of analysis and experimental design. SYK wrote the manuscript with assistance from HLK and SDY.
Author details
Se Young Kim (Assistant Manager)/Hye Lim Kim (Manager)/Sungdong Yu (Manager)/Seonmi Ahn (Manager), Yuhan Natural Product R&D Center, Yuhan Care Co., Ltd., 5 Saneopdanji 2-gil, Pungsan-eup, Andong-si, Gyeongsangbuk-do 36618, Korea; Aeri Song (Deputy Senior Manager)/Hyunje Park (Director), Yuhan Natural Product R&D Center Yuhan Care Co., Ltd., 25, Tapsil-ro 35beon-gil, Giheung-gu, Yongin-si, Gyeonggi-do 17084, Korea; Kijun Seong (Senior Manager)/Ilbum Park (Managing Director), Yuhan Care R&D Center, Yuhan Care Co., Ltd., 25, Tapsil-ro 35beon-gil, Giheung-gu, Yongin-si, Gyeonggi-do 17084, Korea; Jongsoo Kang (CEO), Yuhan Care Co., Ltd., 108, Yeoui-daero, Yeongdeungpo-gu, Seoul 07335, Korea.
Figure 1.Chemical structures of major cannabinoids.(A) THC, tetrahydrocannabinol; (B) CBD, cannabidiol; (C) CBN, cannabinol; (D) CBC, cannabichromene; (E) CBG, cannabigerol.
Figure 2.Chromatograms of CBD and THC.(A) CBD; (B) THC. CBD, cannabidiol; THC, tetrahydrocannabinol.
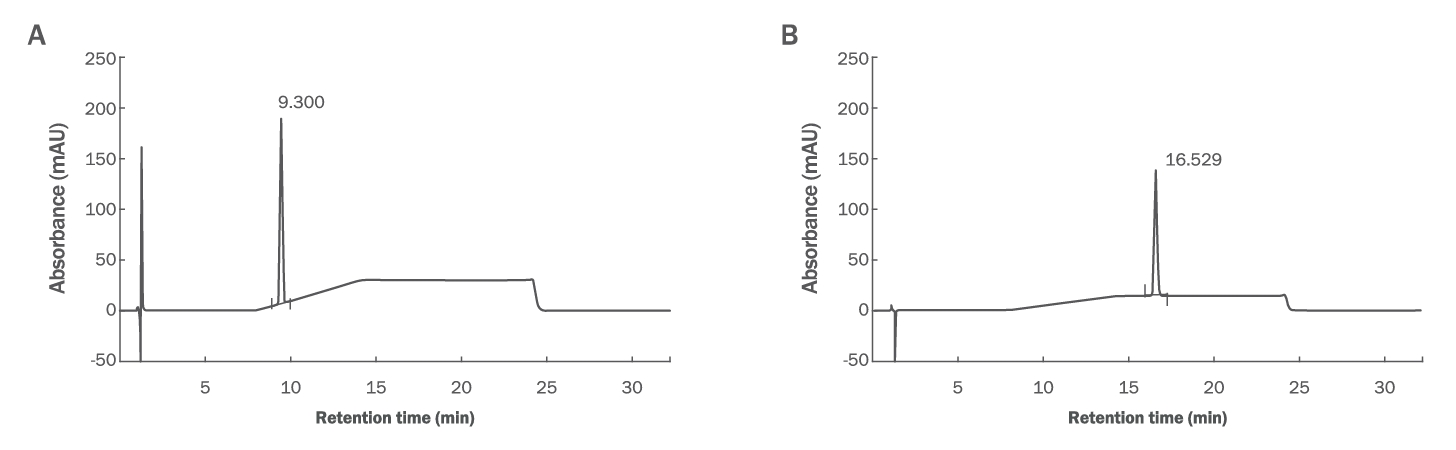
Figure 3.Inhibition effect of CBD on NO production in an LPS-induced RAW 264.7 cell model of inflammation.(A,C) Viability of cells treated with sample (CBD, TECA, MA, and PA). (B, D) NO production level of LPS-induced cells treated with sample (CBD, TECA, MA, and PA). Data are represented as mean±SD (n=3). *p<0.05, **p<0.01, ***p<0.001 compared with the control or LPS group. NO, nitric oxide; LPS, lipopolysaccharide; CBD, cannabidiol 4/mL; Con, control; TECA, titrated extract of Centella asiatica 50/mL; MA, madecassoside 5000 μg/mL; PA, D-panthenol 400 μg/mL; SD, standard deviation.

Figure 4.Inhibitory effect of CBD cream on SDS-induced IL-1α production in the KeraSkinTM model.(A)Viability of SDS-induced cells treated with CBD cream. (B)Levels of SDS-induced IL-1α in cells treated with CBD cream. Data are represented as mean±SD (n=3). *p<0.05, **p<0.01, ***p<0.001 compared with the control or SDS group. IL, interleukin; SDS, sodium dodecyl sulfate; PC, positive control (Bepanthen ointment 0.5%); CBD, cannabidiol 4 μg/mL; SD, standard deviation.

Table 1.High performance liquid chromatography solvent system program
Table 2.Formulation of cream containing cannabidiol ReferencesAnsel J, Perry P, Brown J, Damm D, Phan T, Hart C, Luger T, Hefeneider S. Cytokine modulation of keratinocyte cytokines. Journal of Investigative Dermatology 94: 101-107. 1990.
Burstein S. Cannabidiol (CBD) and its analogs: a review of their effects on inflammation. Bioorganic & Medicinal Chemistry 23: 1377-1385. 2015.
Dong L, Yin L, Zhang Y, Fu X, Lu J. Anti-inflammatory effects of ononin on lipopolysaccharide-stimulated RAW 2647 cells. Molecular Immunology 83: 46-51. 2017.
Franco C, Protti S, Porta A, Pollastro F, Profumo A, Mannucci B, Merli D. Stability of cannabidiol (CBD) in solvents and formulations: a GC-MS approach. Results in Chemistry 4: 100465-100471. 2022.
Gul W, Gul SW, Radwan MM, Wanas AS, Mehmedic Z, Khan II, Sharaf MH, ElSohly MA. Determination of 11 cannabinoids in biomass and extracts of different varieties of cannabis using high-performance liquid chromatography. Journal of AOAC International 98: 1523-1528. 2015.
Han JH, Kim SY Kim, Lee SH, Kim JS, Chang YJ, Jeong TC, Kang MJ, Kim TS, Yoon HS, Lee GY, Bae SJ, Lim KM. Metoo validation study for in vitro skin irritation test with a reconstructed human epidermis model, KeraSkin™ for OECD test guideline 439. Regulatory Toxicology and Pharmacology 117: 104725-104738. 2020.
Herrero M, Mendiola JA, Cifuentes A, Ibáñez E. Supercritical fluid extraction: recent advances and applications. Journal of Chromatography A 1217: 2495-2511. 2010.
Hwang SJ, Kim YW, Park Y, Lee HJ, Kim KW. Anti-inflammatory effects of chlorogenic acid in lipopolysaccharide-stimulated RAW 2647 cells. Inflammation Research 63: 81-90. 2014.
Jang HH. Effects of acetyl glutamine on the improvement of skin barrier and inhibition of senescence. Asian Journal of Beauty and Cosmetology 16: 579-589. 2018.
Jo JH, Roque K, Sin SJ, Cho AR, Heo Y. Basal expression of pro-inflammatory cytokines in a reconstructed human epidermis developed in Korea. Journal of alternative to Animal Experiments 7: 35-38. 2013.
Kim SH, Lee JB. A study on the antioxidative and anti-inflammatory properties of gloiopeltis furcate extract obtained using different concentrations of ethanol. Asian Journal of Beauty and Cosmetology 21: 41-50. 2023.
Marzorati S, Friscione D, Picchi E, Verotta L. Cannabidiol from inflorescences of Cannabis sativa L: green extraction and purification processes. Industrial Crops and Products 155: 112816-112823. 2020.
Devinsky O, Verducci C, Thiele EA, Laux LC, Patel AD, Filloux F, Szaflarski JP, Wilfong A, Clark GD, Park YD, et al. Open-label use of highly purified CBD (Epidiolex®) in patients with CDKL5 deficiency disorder and Aicardi, Dup15q, and Doose syndromes. Epilepsy & Behavior 86: 131-137. 2018.
Giacoppo S, Bramanti P, Mazzon E. Sativex in the management of multiple sclerosis-related spasticity: an overview of the last decade of clinical evaluation. Multiple Sclerosis and Related Disorders 17: 22-31. 2017.
Mechoulam R, Parker LA, Gallily R. Cannabidiol: an overview of some pharmacological aspects. The Journal of Clinical Pharmacology 42: 11-19. 2002.
Mechoulam R, Peters M, Murillo-Rodriguez E, Hanus LO. Cannabidiol--recent advances. Chemistry & Biodiversity 4: 1678-1692. 2007.
Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65: 55-63. 1983.
Muthumalage T, Rahman I. Cannabidiol differentially regulates basal and LPS-induced inflammatory responses in macrophages, lung epithelial cells, and fibroblasts. Toxicology and Applied Pharmacology 382: 114713-114725. 2019.
Qamar S, Manrique YJ, Parekh HS, Falconer JR. Development and optimization of supercritical fluid extraction setup leading to quantification of 11 cannabinoids derived from medicinal cannabis. Biology 10: 481-499. 2021.
Rochfort S, Isbel A, Ezernieks V, Elkins A, Vincent D, Deseo MA, Spangenberg GC. Utilisation of design of experiments approach to optimise supercritical fluid extraction of medicinal cannabis. Scientific reports 10: 9124-9131. 2020.
Sangiovanni E, Fumagalli M, Pacchetti B, Piazza S, Magnavacca A, Khalilpour S, Melzi G, Martinelli G, Dell'Agli M. Cannabis sativa L. extract and cannabidiol inhibit in vitro mediators of skin inflammation and wound injury. Phytotherapy Research 33: 2083-2093. 2019.
Valizadehderakhshan M, Shahbazi A, Kazem-Rostami M, Todd MS, Bhowmik A, Wang L. Extraction of cannabinoids from Cannabis sativa L. (Hemp)—Review. Agriculture 11: 384-404. 2021.
Yang EJ, Kim JG, Kim JY, Kim SC, Lee NH, Hyun CG. Anti-inflammatory effect of chitosan oligosaccharides in RAW 264.7 cells. Central European Journal of Biology 5: 95-102. 2010.
Yu SD, Kim HL, Seong KJ, Jeon JT, Song AR, Kang JS, Park IB. A study on the potency and stability of the cream containing cannabidiol extracted Cannabis sativa L. from Korea. Journal of Society of Cosmetic Scientists of Korea 48: 313-319. 2022.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||