요약목적:국화과(Compositae)의 한 품종인 감국(Chrysanthemum indicum Linne)은 예로부터 전통적인 약초로 사용되어 왔다. 감국의 다양한 생물학적 기능이 보고 되었음에도 불구하고 미용기능식품과 화장품 소재로서의 역할과 기능은 명확하게 밝혀지지 않았다. 그러므로, 본 연구에서 우리는 감국 물 추출물(CIW)을 제조하고 항산화 활성, 지방축적 억제활성 및 hu man skin fibroblasts(HSF) 세포에서 피부 섬유에 관련된 유전자들의 조절 기능을 통해 감국 추출물의 미용기능식품 및 화장품 소재로서의 가능성을 평가하고자 한다.
방법:CIW의 항산화 활성은 금속 킬레이팅 활성과 환원력으로 평가하였다. 3T3-L1 세포 및 HSF에서 CIW의 세포독성은 MTT assay로 평가하였다. CIW의 지질축적 억제활성은 Oil Red O (ORO) 염색법 및 현미경 관찰을 통해수 행하였다. HSF 세포에서 피부 섬유와 관련된 유전자들의 mRNA 발현 수준은 RT-PCR 분석법을 통해 평가하였다.
결과:금속 킬레이팅 활성 및 환원력을 통한 CIW의 항산화 활성은 농도 의존적으로 증가하였다. 3T3-L1 세포와 HS F에서 CIW를 24 h 동안 처리하였을 때, 100 μg/mL 이하의 농도에서는 세포독성이 발견되지 않았으며, 이후 세포실험에서는 100 μg/mL 이하의 CIW를 사용하였다. 3T3-L1 세포에서 CIW를 10, 50, 100 μg/mL의 농도로 처리하였을 때, 유의적인 지방축적 억제활성을 나타냈으며, CIW를 처리한 HSF 세포에서 fibronectin와 COL1A2와 같은 피부 섬유와 관련된 유전자의 mRNA 발현 수준을 상향조절 하였다.
AbstractPurpose:
Chrysanthemum indicum Linne (CI) has been used as a traditional medicine. Although several biological effects of CI have been reported, the precise role and function of CI as nutri-cosmetic and cosmetic materials remain unclear. Therefore, we prepared water extract of Chrysanthemum indicum Linne (CIW). And nutri-cosmetic potential was discussed through evaluation of anti-oxidant, anti-adipogenic in 3T3-L1 cells and regulatory function of skin fibril-related genes in human skin fibroblast (HSF).
Methods:The anti-oxidant activity of CIW was evaluated through metal chelating activity and reduction potential. The cytotoxicity of CIW in 3T3-L1 and HSF was evaluated by MTT assay. The anti-adipogenic effect of CIW was examined by Oil Red O (ORO) staining and microscopy observation in 3T3-L1 cells. The mRNA expression levels of skin fibril-related genes in HSF were analyzed by reverse transcription-polymer chain reaction (RT-PCR).
Results:The anti-oxidant activity of CIW was increased in a dose dependent manner. The CIW treatment up to 100 μg/mL for 24 h did not affect to the viability of 3T3-L1 cells and HSF. Thus, up to 100 μg/mL of CIW was chosen in cell-based assay. The treatment of 10, 50, and 100 μg/mL CIW significantly inhibited 3T3-L1 adipogenesis by 5.17%, 72.80%, and 104.09%. In addition, upregulated mRNA expression levels of skin fibril-related genes such as fibronectin and type Ⅰ collagen α2 (COL1A2) were observed in CIW-treated HSF.
中文摘要目的: 菊科植物的一种野菊花已被用来作为一个传统医药。虽然野菊花有很多种生理活性,但是作为美容功能食品和化妆品原料的作用和功能还没有完全明确。因此通过评价菊花提取物(CIW)的抗氧化活性和抑制脂肪形成以及在HSF细胞中皮肤纤维相关的基因的调节功能,进一步调查作为美容功能性食品原料及化妆品原料的可行性
方法:CIW的抗氧化活性通过金属螯合活动和还原力来评价。3T3-L1细胞和HSF中CIW的细胞毒性利用MTT assay来评价。CIW的抑制脂肪堆积活性通过 Oil Red O (ORO)染色法和显微镜观察来判断。HSF细胞中对皮肤纤维相关的基因的mRNA表达水平利用RT-PCR分析法来评价。
Introduction산소는 에너지를 생산하는 생명체의 생물학적인 과정에서 필수적으로 요구되지만 인체에서 2-3%의 산소는 활성산소종(reactive oxygen species, ROS)과 유리 라디칼(free radicals)로 전환된다고 알려져 있다(Zhang et al., 2016). ROS는 인체의 다양한 대사과정 중에 발생하며, 세포의 신호 및 신경 전달에 중요한 역할을 하고 일반적인 조직의 항상성을 유지한다. 건강한 사람에게서 유리 라디칼의 생성은 superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GPx), 그리고 glutathione (GSH) 등과 같은 항산화 방어 메커니즘에 의해 보호되지만, 체내 유리 라디칼의 생성과 항산화 방어 시스템이 불균형해지면 산화적 스트레스를 유발하고, 그 결과 암, 당뇨병, 그리고 비만과 같은 만성질환에 원인이 될 수 있다(Salla et al, 2016). 따라서 체내 유리 라디칼의 생성을 적정 수준으로 유지시키는 것은 만성질환을 예방하는데 중요하다.
만성질환 중 하나인 비만은 체지방이 과도하게 축적된 상태를 일컫는다. 일반적으로 남성은 체지방이 체중의 25% 이상, 여성은 30% 이상일 경우 비만이라고 한다. 비만은 에너지 섭취와 소비의 불균형 상태이며, 이상지질혈증, 제2형 당뇨병, 그리고 고혈압을 포함하는 만성질환의 유발과 긴밀한 연관성이 있어 건강상 심각한 위험인자가 될 수 있다(Kim et al., 2014; Park et al., 2008). 일반적으로 지방조직에 존재하는 전지방세포(preadipocytes) 및 전구세포는 지방세포 분화과정(adipocytes differentiation, adipogenesis)을 통해 성숙한 지방세포로 되는 과정을 겪으므로 adipogenesis를 효과적으로 조절하는 것은 비만을 예방 또는 치료하기 위해 중요한 부분이다(Cho et al., 2015).
Adipogenesis는 전지방세포에서 지방세포로 분화하는 것으로, 다양한 전사인자(transcriptional factors) 및 유전자의 발현에 의해 조절된다(Jeong et al., 2005). Adipogenesis 과정동안 CCAAT/enhancer-binding protein β (C/EBPβ)와 C/EBPδ가 초기에 발현되고, 뒤이어 peroxisome proliferator-activated receptor γ (PPARγ)의 발현에 의해 지방세포 분화는 가속화되고 뒤이어 C/EBPα가 발현된다(Lee et al., 2015). 따라서 이러한 adipogenesis 과정을 효과적으로 조절하는 것은 비만예방 및 지질축적 억제에 있어 중요한 전략 중 하나이다.
피부는 크게 표피, 진피, 그리고 피하지방으로 구성되어 있으며, 표피와 진피는 주로 콜라겐 섬유, elastic 섬유, proteoglycan 및 glycoprotein과 같은 기질로 구성된다(Kao et al., 2016). 지방의 과도한 축적 및 비대가 발생할 경우 여분의 피하지방은 진피내의 섬유 격막에서 피부 안으로 이어지는 정상적인 피부구조의 변화를 초래할 뿐만 아니라, 지방생성 및 분해 사이의 불균형에 의해 결합조직 등의 노화를 초래할 수 있다. 또한 과도한 피하지방의 축적은 셀룰라이트를 생성하며, 피부 단백질의 구조를 붕괴시켜 피부 탄력과 콜라겐 구조형성 등에 부정적인 영향을 미친다(Knobloch & Kraemer, 2015; Mohamed et al., 2011). 콜라겐은 피부 세포 외 기질의 주요 구성요소로서 피부의 형태를 유지하는 역할을 하며, Type Ⅰ 콜라겐이 인간 피부의 약 70-80%를 구성하고 있다(Ågren et al., 2015). 피부 섬유 구조를 구성하는 콜라겐을 생성하고 탄력을 유지하는 데 있어 fibronectin의 역할 또한 중요하다. Fibronectin은 세포 외 기질 성분 중 비콜라겐 단백질로서, 피부의 밀착성과 조직 복구 과정에서 중요한 역할을 하는 것으로 알려져 있다(de Sousa et al., 2014). 최근에는 지방축적 억제활성을 가지면서 상대적으로 안전한 천연물 기능성 소재들의 탐색에 대한 연구가 활발히 진행되고 있으며(Royer et al., 2013), 이를 활용한 미용기능식품 및 화장품 개발에 대한 관심이 크다.
본 연구에 사용된 국화의 품종 중 감국(Chrysanthemum indicum Linne)은 국화과(Compositae) 국화속(Chrysanthemum)에 속하는 다년생 초본으로 luteolin, apigenin, 그리고 cumambrin 등의 생리활성 물질을 포함하는 것으로 알려져 있다(Ryu et al., 1994). 감국의 꽃과 싹은 전통적으로 다양한 면역관련 질환과 고혈압 예방, 그리고 한국의 민간 의학에서 폐렴, 대장염, 구내염, 그리고 발열 등 여러 가지 감염성 질환의 예방 및 치료에 사용한 것으로 알려져 있다(Wang et al., 2012). 감국의 생리활성과 관련하여 골다공증 예방(Luyen et al., 2015), 항염증(Luyen et al., 2015), 항암(Kim et al., 2013), 그리고 항균활성(Shunying et al., 2005) 등이 기 보고되었지만, 미용기능식품 및 화장품 소재로서의 감국에 대한 평가는 미비한 실정이다.
따라서 본 연구에서는 감국의 항산화 활성, 3T3-L1 세포에서 adipogenesis 억제활성 및 HSF에서 피부섬유구조 형성과 관련한 fibronectin 및 type I collagen α2 (COL1A2) 유전자의 발현에 미치는 영향을 분석하여 감국의 미용기능식품 및 화장품 소재로서의 활용 가능성에 대해 평가하였다.
Methods1. 실험재료본 실험에 사용된 감국(Chrysanthemum indicum Linne)은 광우한약품(Changewon, Korea)에서 구입하여 사용하였다. 3-(4,5-dimethylthiazol-2-yl-2,5-diphenyltetrazolium bromide (MTT), 3-isobutyl-1-methylxanthine (IBMX), insulin, dexamethasone (DEX), Oil Red O (ORO), 그리고 chloroform은 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구입하였으며, 세포배양 등에 사용된 Dulbecco’s Modified Eagle’s Medium (DMEM), penicillin-streptomycin, fatal bovine serum (FBS), bovine calf serum (BCS), 그리고 RNase-free water는 Welgene Inc. (Daegu, Korea)에서 구입하여 사용하였다. ORO 염색법에 사용된 2-propanol, 그리고 dimethyl sulfoxide (DMSO)는 Junsei Chemical Co. (Tokyo, Japan)에서 구입하였으며, formaldehyde는 Bio Basic Inc. (Markham, ON, Canada)에서 구입하였다. RT-PCR에 사용된 AccuPowerⓇ CycleScript RT PreMix는 Bioneer (Daejeon, Korea)에서, TRIzolⓇ은 Life Technologies (Carlsbad, CA, USA)에서 구입하여 사용하였다. 본 실험에 사용된 세포주인 3T3-L1 세포는 한국세포주은행 (Seoul, Korea)에서, human skin fibroblasts (HSF)는 American Type Culture Collection (ATCC, Manassas, VA, USA)에서 분양 받아 사용하였다.
2. 감국 물 추출물의 제조건조된 감국을 분쇄한 후, 분쇄된 감국에 10배수의 물을 가하고 121℃에서 20 min 동안 가열하여 추출하였다. 이후 Whatman No.2 여과지를 이용하여 여과한 뒤 진공동결건조기(PVTFD-10R; Ilshinbiobase, Dongducheon, Korea)를 이용하여 동결건조 시킨 후 -20℃에서 보관하면서 이후 분석에 사용하였다. 감국 물 추출물의 추출 수율(%, w/w-dry base)은 추출 전 감국 무게에 대한 건조 후 감국 무게의 백분율로 나타내어 41.9% (w/w)의 추출 수율을 보였다. 이후 감국 물 추출물은 CIW로 표기하였다.
3. 금속 킬레이팅 활성(Metal chelating activity)CIW의 금속 킬레이팅 활성은 Mariana의 방법을 일부 변형하여 사용하였다(Mariana et al., 2003). CIW를 10, 50, 100 그리고 500 μg/mL 농도로 증류수에 녹인 용액 200 μL와 0.4 μM CuSO4 용액 200 μL를 잘 섞어 주었다. 그 후 0.05 μM calcein 용액 100 μL를 넣어 다시 섞어주었으며, 형광분석기(GENios; Tecan Trading AG, Salzburg, Austria)를 이용하여 excitation 파장 485 nm와 emission 파장 535 nm에서 형광의 강도를 측정하였다. 아무것도 처리 하지 않은 calcein 용액의 형광값을 대조군으로 하여 CIW의 금속 킬레이팅 활성(% of control)을 계산하였다.
4. 환원력(Reduction potential)CIW의 환원력은 Aruoma의 방법을 일부 변형하여 측정하였다(Aruoma et al., 1998). 10, 50, 100 그리고 500 μg/mL 농도의 CIW 용액 40 μL에 10 mM phosphate buffer (pH 7.4)에 녹인 100 μM CuCl2 용액 20 μL와 250 μM neocuproin 용액 80 μL를 함께 섞어준 후 실온에서 1 h 동안 반응시킨다. 반응액의 흡광도를 microplate reader를 이용하여 454 nm 파장에서 흡광도를 측정하였다. 결과 값은 Cu+1/neocuproin의 extinction coefficient (7.95×103M-1cm-1)를 사용하여 흡광도로부터 계산된 Cu+1의 농도로서 환원력을 표시하였다.
5. 세포배양(3T3-L1 및 HSF) 및 지방세포 분화3T3-L1 전지방세포는 DMEM 배지에 10% BCS와 1% penicillin-streptomycin을 첨가하여 37℃, 5% CO2 환경에서 배양되었다. 3T3-L1 세포의 지방세포 분화와 CIW 처리는 Figure 1에 나타내었다. 3T3-L1 전지방세포가 세포배양접시에 100% 자랐을 때를 Day –2라고 표기하였다. 분화유도 배지(Differentiation medium; DM)를 이용하여 지방세포 분화를 유도한 날을 Day 0라고 표기하였으며, 분화유도 배지는 10% FBS와 1% penicillin-streptomycin이 첨가된 DMEM 배지에 500 μM의 IBMX, 5.2 μM의 DEX, 그리고 167 nM의 insulin을 포함하여 Day 0부터 Day 2까지 48 h 동안 처리하였으며, 분화유도 후 배지(Post-differentiation medium; Post-DM)는 10% FBS와 1% penicillin-streptomycin이 첨가된 DMEM 배지에 167 nM의 insulin만을 추가하여 Day 2에서 Day 4까지 사용하였다. 이후 DMEM 배지에 10% FBS와 1% penicillin-streptomycin을 첨가한 후 Day 4에서 Day 6까지 사용하였으며 Day 6에 지방세포 분화를 종료하였다(Figure 1). RT-PCR 분석을 위한 HSF 세포는 DMEM배지에 10% FBS와 1% penicillin-streptomycin을 첨가하여 37℃, 5% CO2 환경에서 2일마다 배지를 교체하였다.
6. MTT assay3T3-L1 세포 및 HSF 세포에서 CIW의 세포독성을 평가하기 위해 MTT assay를 실시하였다. 3T3-L1 세포와 HSF에 CIW를 10, 50, 100, 200, 400 그리고 800 μg/mL의 농도로 24 h 동안 처리한 후, PBS에 용해된 MTT 시약을 최종농도 200 μg/mL가 되도록 DMEM 배지에 희석하여 추가로 37℃ incubator에서 1 h 배양하였다. 반응이 끝난 후 배지를 완전히 제거하고 DMSO 300 μL를 첨가하여 보라색의 formazan을 용해시킨 후 96-well plate에 100 μL씩 넣어 microplate reader(VersaMax; Molecular Devices, Sunnyvale, CA, USA)를 이용하여 570 nm에서 흡광도를 측정하였다. 아무것도 처리되지 않은 3T3-L1 세포와 HSF의 흡광도를 대조군으로 하여 세포 독성(% of control)을 평가하였다.
7. Adipogenesis 억제활성 평가CIW가 3T3-L1 세포의 adipogenesis 과정에 어떠한 영향을 미치는지 알아보기 위하여 ORO 염색법을 통해 평가하였다. CIW는 3T3-L1 전지방세포에 10, 50, 그리고 100 μg/mL의 농도로 Day -2에서 Day 6까지 총 8일 동안 처리하였으며, ORO 염색은 Day 6에 실시하였다. 분화가 완료된 3T3-L1 지방세포는 실온에서 30 min 동안 3.7% (v/v) formaldehyde를 사용하여 고정시켰다. 고정된 3T3-L1 지방세포는 3 mg/mL의 ORO를 이용하여 실온에서 15 min 동안 염색시켰다. 지방세포내 지방구와 결합된 ORO는 DMSO를 사용하여 용해시키고 96-well plate에 100 μL/well씩 옮겨 microplate reader를 이용하여 510 nm에서 흡광도를 측정하였다. 시료를 처리하지 않은 Day 6의 3T3-L1 지방세포를 대조군으로 하여 지방 축적률(% of control)을 계산하였다. 또한 CIW의 처리가 3T3-L1 지방세포의 지방구 수 및 크기에 미치는 영향을 분석하였다. CIW는 위의 방법과 동일하게 처리하였으며, 3T3-L1 세포의 지방구 수 및 크기는 Day 6에 현미경을 통해 관찰하였다.
8. RT-PCR analysisCIW 처리가 HSF의 콜라겐 형성과 피부 탄력에 관여하는 유전자 발현에 어떠한 영향을 미치는지 알아보고자 RT-PCR을 통해 mRNA 발현수준을 분석하였다. HSF는 CIW에 10, 50, 그리고 100 μg/mL의 농도로 2 h 처리되었으며, TRIzolⓇ을 이용하여 total RNA를 추출하였다. TRIzolⓇ 추출물에 100 μL의 chloroform을 넣고 15 s 동안 잘 혼합한 후, 17,000 rpm에서 20 min 동안 원심 분리하여 상층액을 얻었다. 획득한 상층액에 250 μL의 isopropanol을 넣고 10 min 동안 상온에 정치한 다음 17,000 rpm에서 15 min 동안 원심 분리하여 RNA를 분리하였다. 분리된 RNA는 정량한 뒤 CycleScript RT PreMix을 이용하여 cDNA를 합성하였다. 합성된 cDNA는 thermal cycler (T100; Bio-Rad, Hercules, CA, USA)를 이용하여 PCR을 수행한 후 2% (w/v) 아가로즈 젤에 35 min 동안 전기영동 하여 mRNA 유전자 발현 수준을 분석하였다. 본 실험에 사용된 primer sequences는 Table 1과 같다.
Results and Discussion1. CIW의 금속 킬레이팅 활성CIW의 금속 킬레이팅 활성은 calcein 방법을 이용하여 평가하였다. Calcein 유리 상태일 때 강한 형광값을 나타내지만, Cu2+, Ca2+, Mg2+ 그리고 Zn2+ 등의 2가 이온과 결합하여 복합체를 형성하면 형광값이 감소되는 원리를 이용한 방법이다. Calcein 자체의 형광값을 대조군 100%로 하여 CuSO4만을 첨가하였을 때 대조군에 비해 53.41% 형광값이 감소한 46.59%의 calcein 형광값을 얻었다. 반면 CIW를 10, 50, 100, 그리고 500 μg/mL의 농도로 처리하였을 때 calcein 형광값은 53.55%, 69.88% 70.14%, 그리고 75.10%로 CuSO4만을 첨가하였을 때 보다 각각 6.96%, 23.29%, 23.55%, 그리고 28.51% 금속 킬레이팅 활성은 유의적으로 증가하였다(Fig. 2). 항산화 활성에서 금속 킬레이팅 활성의 중요성은 이전 연구에서 다양하게 보고되었다. 체내 자유 라디칼로 잘 알려진 hydroxyl radical (HO·)은 대표적인 전이금속인 철, 구리 등과 H2O2가 반응하는 Fenton reaction (2가 전이금속+H2O2→HO·)에 의해 생성되는데 체내에서 높은 독성을 나타내는 것으로 알려져 있다(Wei & Guo, 2007). 그러므로 CIW의 금속 킬레이팅 활성은 2가 전이금속이 H2O2와 반응하는 것을 차단 또는 지연시킴으로써 HO· 생성을 억제시킬 수 있음을 시사한다.
2. CIW의 환원력CIW의 전자공여능은 환원력으로 평가하였다. 즉, Cu2+이온을 CIW가 Cu1+로 환원시키는 능력을 측정하여 평가하였다. CIW의 환원력을 측정한 결과, 10, 50, 100 그리고 500 μg/mL CIW는 Cu2+를 각각 4.36, 13.04, 22.3, 그리고 23.19 μM 수준으로 Cu1+를 환원시켰으며, CIW 농도가 증가할수록 Cu2+에 대한 환원력은 유의적으로 증가하였다(Figure 3). 따라서, 본 결과는 CIW의 전자공여능을 통해 산화를 안정화 시키는 항산화 소재로서의 가능성을 보여주는 결과이다. 항산화 활성을 측정하는 방법에는 크게 수소원자를 전달하는 기전을 통한 측정법(hydrogen atom transfer based assay)과 전자공여능(electron transfer based assay)을 통한 측정법이 알려져 있다(Prior et al., 2005). 전자공여능을 통해 항산화 활성을 평가하는 대표적인 평가법은 2,2-diphenyl-1-picrylhydrazyl (DPPH) assay, copper reduction assay (CUPRAC), trolox equivalent anti-oxidant capacity (TEAC) assay 등이 알려져 있으며, 항산화 측정 방법에 따른 각각의 장단점 등은 여러 연구들을 통해 보고되어 왔다. 본 연구에서 CIW의 농도 의존적인 전자공여능의 증가는 확인하였지만, 향후 피부 세포모델에서 발생되는 ROS에 미치는 영향 또는 in vivo 동물모델에서 혈장 항산화 지표에 미치는 영향 등은 추후 연구를 통해 확인되어야 할 것으로 생각된다.
3. 3T3-L1 세포 및 HSF에서 CIW의 세포독성3T3-L1 세포와 HSF에서 CIW의 세포독성을 평가하기 위해 MTT assay를 실시하였다. 100% 가득 찬 상태의 3T3-L1 세포와 HSF 세포에 10, 50, 100, 200, 400, 그리고 800 μg/mL의 농도로 CIW를 24 h 처리한 결과, 3T3-L1 세포에서는 각각 96.40%, 100.90%, 112.97%, 107.03%, 101.62%, 그리고 97.77%로 대조군과 비교하여 세포생존율에 유의적인 영향을 미치지 않았다(Table 2). 그러나 HSF에 CIW를 10, 50, 100, 200, 400, 그리고 800 μg/mL의 농도로 24 h 동안 처리한 결과, 10, 50, 그리고 100 μg/mL 농도에서는 각각 세포생존율이 93.37%, 102.24%, 그리고 86.70%로 대조군과 비교하여 유의적인 차이가 없었다. 반면 200, 400, 그리고 800 μg/mL CIW 처리군에서 각각 75.34%, 77.14%, 그리고 84.93%로 유의적인 세포독성이 발견되었다. 따라서, 이후 실험에서는 세포독성이 발견되지 않은 100 μg/mL 이하의 CIW를 사용하여 실험을 진행하였다.
4. 3T3-L1 세포에서 CIW의 adipogenesis 억제활성CIW 처리가 3T3-L1 지방세포의 adipogenesis를 억제하는지 알아보기 위하여 세포독성이 나타나지 않은 10, 50, 그리고 100 μg/mL의 농도로 CIW를 Day -2부터 Day 6까지 처리한 후 Day 6에 ORO 염색법을 통해 평가하였다. 10, 50, 그리고 100 μg/mL 농도로 CIW를 처리한 결과, 아무것도 처리하지 않은 Day 6의 지방세포를 100%로 하였을 때 CIW 처리군은 각각의 농도에서 94.83%, 27.20%, 그리고 -4.09%로 농도 의존적이며 유의적인 adipogenesis 억제활성을 나타냈다(Figure 4A). 또한 CIW 처리가 3T3-L1 세포 내 지방구 수와 크기에 미치는 영향을 알아보기 위해 분화가 끝난 후의 3T3-L1 지방세포를 위의 방법과 동일하게 처리 하여 Day 6에 ORO 염색 후 현미경으로 관찰한 결과, 분화시키지 않은 3T3-L1 전지방세포에서는 지방구가 발견되지 않았으며 지방세포 분화를 유도시킨 대조군 지방세포에서는 다량의 지방구가 형성된 것을 확인하였다(Figure 4B). CIW를 10, 50, 그리고 100 μg/mL 농도로 처리 했을 때 Figure 4의 결과와 유사하게 세포 내 지방구의 수 및 크기가 유의적으로 감소된 것이 관찰되었다. 이전의 연구에 따르면 감국에는 luteolin, apigenin, 그리고 cumambrin 등의 생리활성 물질이 존재하는 것으로 보고되었다(Ryu et al., 1994). 이 중 luteolin은 PPARγ의 조절을 통해 adipogenesis를 억제하는 것으로 알려져 있으며(Park et al., 2009), 엉겅퀴와 그의 주요 생리활성성분인 apigenin은 3T3-L1 세포의 PPARγ와 C/EBPα의 하향조절을 통해 항비만 활성을 나타내는 것으로 보고 되었다. 이상의 결과를 볼 때 CIW의 adipogenesis 억제활성은 CIW에 존재하는 luteolin 및 apigenin가 adipogenic 전사인자의 하향조절을 통해 지방축적 억제활성 효과에 영향을 줄 것으로 추측되며, 향후 CIW의 처리를 통해 지방세포의 PPAR γ, C/EBPα, fatty acid synthase (FAS), 그리고 adipocyte Protein 2 (aP2, fatty acid binding protein) 등과 같은 지방세포 특이적 유전자 및 단백질의 발현 수준에 대한 분석이 요구된다.
5. HSF에서 CIW 처리가 fibronectin 및 COL1A2 발현에 미치는 영향피부에 있어 fibronectin, type I 콜라겐, 그리고 type III 콜라겐은 피부구조를 형성하는데 있어 중요한 역할을 하는 단백질이다(Martin et al., 1990). Fibronectin은 피부세포의 성장, 부착, 구조형성 및 상처회복에 있어 중요한 역할을 하는 것으로 알려져 있으며(Clark, 1983), 콜라겐 단백질은 type I, II, III, IV 그리고 XI 총 5가지의 형태가 보고되었으며, 그 중 type I 콜라겐은 피부의 진피, 힘줄, 뼈, 그리고 치아 등에 존재하며 조직의 탄력을 유지하는데 중요한 역할을 한다(de Souza, 2002). 따라서, 본 연구에서는 CIW 처리가 HSF의 fibronectin 및 type I 콜라겐의 발현수준에 어떠한 영향을 미치는지 알아보고자 하였으며, HSF에 CIW를 10, 50, 그리고 100 μg/mL의 농도로 2 h 동안 처리하고 fibronectin과 COL1A2의 mRNA 발현 수준을 RT-PCR 분석법을 통해 측정하였다. 그 결과, CIW 처리 농도가 증가할수록 fibronectin과 COL1A2의 mRNA 발현 수준 또한 증가하였다(Figure 5). 이전 연구에 따르면, fibronectin은 세포 외 matrix 사이의 주 성분으로 배아 발달 동안 세포 부착 및 조직 형성에서 중요한 역할을 하여 피부의 탄력 향상에 기여한다고 알려져 있다(Brennan & Hocking, 2016). 따라서, CIW 처리에 의한 fibronectin과 COL1A2의 mRNA 발현 수준의 증가는 피부의 콜라겐 합성 및 탄력 증진에 기여할 수 있음을 보여주는 결과라 생각된다. 그러나 또 다른 연구결과에 따르면 비대흉터(hypertrophic scar) 및 켈로이드(keloids)의 상처 치유반응에서 과량의 fibronectin이 발현된다는 보고가 있으므로(Higashi et al., 1997), 향후 normal skin fibroblasts와 비대흉터 두 모델에서 CIW 처리에 따른 fibronectin 과발현에 대한 비교 연구가 필요할 것으로 생각된다.
Conclusion인체에 과도하게 생성되는 유리 라디칼들은 세포막, 단백질, DNA 그리고 효소 등을 손상시켜 세포의 기능과 작용에 문제를 일으킬 뿐 아니라 암, 동맥경화, 그리고 비만 등의 만성질환의 발생과도 밀접한 관련을 가지고 있다. 지방조직은 포도당 대사와 에너지 항상성 조절 역할을 수행하는 중요한 내분비 기관이지만 비만한 사람에게 과잉 축적된 지방조직은 인슐린저항성을 비롯한 제2형 당뇨병, 이상지 질혈증, 그리고 심혈관 질환과 같은 심각한 대사장애의 주요 원인이 될 수 있다(Kim et al., 2015). 또한 최근 사회적으로 미적인 아름다움이 강조됨에 따라 지방조직의 과도한 축적은 피부의 단백질 구조를 쉽게 허물어 뜨려 피부의 탄력과 콜라겐 형성 등에 부정적인 영향을 미친다고 알려져 있어(Mohamed et al., 2011), 최근에는 항산화 활성, 항비만 활성 및 피부 개선 효과를 가지는 천연물을 탐색하려는 다각적 시도가 이루어지고 있다.
따라서 본 연구에서는 국화의 품종 중 감국을 이용한 물 추출물(CIW)을 제조하여 금속 킬레이팅 활성 그리고 환원력을 통해 항산화 활성을 평가하였다. 또한 과도한 지방의 축적은 피하의 셀룰라이트 형성 및 피부 구조를 변형시킬 수 있다는 보고에 따라 3T3-L1 세포에서 CIW의 지방축적 억제활성 및 HSF에서 피부구조 및 탄력과 밀접한 관련을 가지고 있는 fibronectin과 COL1A2의 발현 수준을 분석하여 CIW의 미용기능식품 및 화장품 소재로서의 활용 가능성을 평가하였다. 그 결과 CIW는 농도 의존적으로 금속 킬레이팅 활성 및 환원력이 증가하였으며, 이를 바탕으로 체내 생성되는 유리라디칼의 소거 및 억제에 기여할 수 있을 것으로 생각된다. 또한 3T3-L1 세포의 adipogenesis 억제활성을 통해 과도한 지방축적으로 인한 셀룰라이트의 형성억제 및 피부구조의 유지에 도움이 될 수 있을 것으로 생각된다. 마지막으로 CIW는 HSF 모델에서 fibronectin 및 COL1A2의 발현수준을 증가시켜 피부의 단백질 구조 형성, 탄력 및 상처재생에 도움을 줄 수 있는 천연물 소재로 활용될 수 있을 것이라 판단된다.
Figure 1.Scheme of 3T3-L1 differentiation and CIW treatment.DM: differentiation medium consist of FBS-DMEM, 0.5 mM IBMX, 5.2 μM DEX, and 167 nM insulin; Post-DM: postdifferentiation medium consist of FBS-DMEM and 167 nM insulin

Figure 3.Reduction potential of CIW.Corresponding letters indicate significant differences between different concentrations of CIW (a-c) based on ANOVA with Duncan’s multiple range test (p<.05).
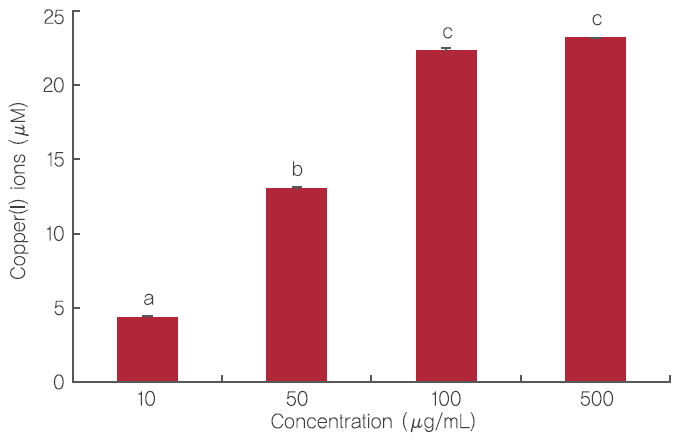
Figure 4.Effect of CIW treatment on the lipid accumulation of 3T3-L1 adipocytes.Lipid accumulation was evaluated by ORO staining and ORO-stained 3T3-L1 adipocyte on Day 6 were quantified using microplate reader at a wavelength of 510 nm (A). The lipid accumulation of 3T3-L1 adipocytes in the presence or absence of CIW was photomicrographed (B). Corresponding letters indicate significant differences between CIW treated and control adipocytes based on Student’s t-test (***p<.001). Pre: 3T3-L1 preadipocytes; Adi: mature 3T3-L1 adipocytes on Day 6.

Figure 5.Effect of CIW treatment on the mRNA expression levels of skin fibril-related genes in HSF.The HSF were exposed to the 10, 50, and 100 μg/mL CIW for 2 h. The mRNA expression levels of skin fibril-related genes such as fibronectin and COL1A2 were examined by RT-PCR analysis. β–actin was used as a control.
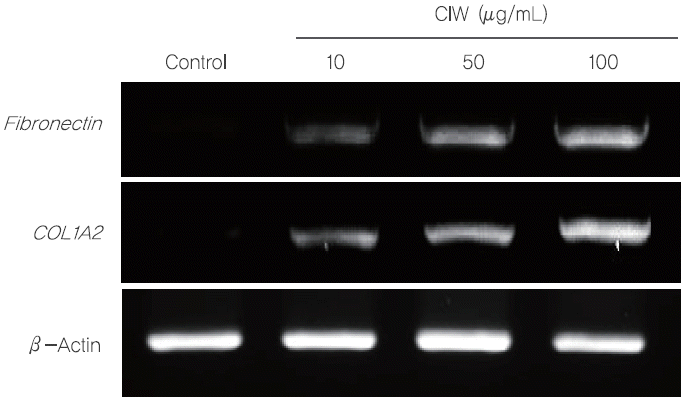
Table 1.Primer sequences for RT-PCR analysis
Table 2.Effect of CIW treatment on the viabilities of 3T3-L1 and human skin fibroblasts References1. Ågren MS, Schnabel R, Christensen LH, Mirastschijski U. Tumor necrosis factor-α-accelerated degradation of type Ⅰ collagen in human skin is associated with elevated matrix metalloproteinase (MMP)-1 and MMP-3 ex vivo. European Journal of Cell Biology 94: 12-21. 2015.
2. Almeida ML, Freitas WE, de Morais PL, Sarmento JD, Alves RE. Bioactive compounds and antioxidant potential fruit of Ximenia americana L. Food Chemistry 192: 1078-1082. 2016.
3. Argirova MD, Ortwerth BJ. Activation of protein-bound copper ions during early glycation: study on two proteins. Archives of Biochemistry and Biophysics 420: 176-184. 2003.
4. Aruoma OI, Deiana M, Jenner A, Halliwell B, Kaur H, Banni S, Corngiu FP, Dessi MA, Aeschbach R. Effect of hydroxytyrosol found in extra virgin olive oil on oxidative DNA damage and on low density lipoprotein oxidation. Journal of Agricultural and Food Chemistry 46: 5181-5187. 1998.
5. Brennan JR, Hocking DC. Cooperative effects of fibronectin matrix assembly and initial cell-substrate adhesion strength in cellular self-assembly. Acta Biomaterialia 32: 198-209. 2016.
6. Cho YL, Min JK, Roh KM, Han BS, Bae KH, Lee SC, Chung SJ, Kang HJ. Phosphoprotein phosphatase 1CB (PPP1CB), a novel adipogenic activator, promotes 3T3-L1 adipogenesis. Biochemical and Biophysical Research Communications 467: 211-217. 2015.
8. de Sousa AP, Gurgel CA, Ramos EA, Trindade RF, de Faro Valverde L, Carneiro TS, Cangussú MC, Pinheiro AL, Dos Santos JN. Infrared LED light therapy influences the expression of fibronectin and tenascin in skin wounds of malnourished rats-A preliminary study. Acta Histochemica 116: 1185-1191. 2014.
10. Higashi K, Kouba DJ, Song YJ, Uitto J, Mauviel A. A proximal element within the human α2(Ⅰ) collagen (COL1A2) promoter, distinct from the tumor necrosis factor-α response element, mediates transcriptional repression by interferon-γ. Matrix Biology 16: 447-456. 1997.
11. Jeong SH, Choi WC, Yoon MC. Effects of fenofibrate on adipogenesis in female C57BL/6J mice. Journal of Biomedical Science 11: 1-8. 2005.
12. Kao AP, Connelly JT, Barber AH. 3D nanomechanical evaluations of dermal structures in skin. Journal of the Mechanical Behavior of Biomedical Materials 57: 14-23. 2016.
13. Knobloch K, Kraemer R. Extracorporeal shock wave therapy (ESWT) for the treatment of cellulite - A current metaanalysis. International Journal of Surgery 24: 210-217. 2015.
14. Kim CW, Kim MC, Kim SM, Nam DW, Choi SH, Kim SH, Ahn KS, Lee EH, Jung SH, Ahn KS. Chrysanthemum indicum L. extract induces apoptosis through suppression of constitutive STAT3 activation in human prostate cancer DU145 cells. Phytotherapy Research 27: 30-38. 2013.
15. Kim HH, Lee YJ, Han TJ, Choi EM. The micosporine-like amino acids-rich aqueous methanol extract of laver (Porphyra yezoensis) inhibits adipogenesis and induces apoptosis in 3T3-L1 adipocytes. Nutrition Research and Practice 9: 592-598. 2015.
16. Kim MO, Song YW, Kim CH, Hwang JK. Kirenol inhibits adipogenesis through activation of the Wnt/β-catenin signaling pathway in 3T3-L1 adipocytes. Biochemical and Biophysical Research Communications 445: 433-438. 2014.
17. Lee CM, Yoon MS, Kim YC. Effects of Pueraria lobata root ethanol extract on adipogenesis and lipogenesis during 3T3-L1 differentiation into adipocytes. Toxicology Research 31: 191-201. 2015.
18. Luyen BT, Tai BH, Thao NP, Cha JY, Lee HY, Lee YM, Kim YH. Anti-inflammatory components of Chrysanthemum indicum flowers. Bioorganic & Medicinal Chemistry Letters 25: 266-269. 2015.
19. Luyen BT, Tai BH, Thao NP, Lee YM, Lee SH, Jang HD, Kim YH. The anti-osteoporosis and antioxidant activities of chemical constituents from Chrysanthemum indicum flowers. Phytotherapy Research 29: 540-548. 2015.
20. Martin M, el Nabout R, Lafuma C, Crechet F, Remy J. Fibronectin and collagen gene expression during in vitro ageing of pig skin fibroblasts. Experimental Cell Research 191: 8-13. 1990.
21. Mohamed SA, Abdel-Mageed HM, Tayel SA, El-Nabrawi MA, Fahmy AS. Characterization of Mucor racemosus lipase with potential application for the treatment of cellulite. Process Biochemistry 46: 642-648. 2011.
22. Park HG, Kim JM, Kim JM, Chung WY, Yoo YJ, Cha JH, Kim JM. Inhibitory effect of ethyl acetate extract of white peach pericarp on adipogenesis of 3T3-L1 preadipocyte cells. Food Science and Biotechnology 17: 1327-1331. 2008.
23. Park HS, Kim SH, Kim YS, Ryu SY, Hwang JT, Yang HJ, Kim GH, Kwon DY, Kim MS. Luteolin inhibits adipogenic differentiation by regulating PPARγ activation. Biofactors 35: 373-379. 2009.
24. Prior RL, Wu X, Schaich K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry 53: 4290-4302. 2005.
25. Royer M, Prado M, García-Pérez ME, Diouf PN, Stevanovic T. Tatjana S. Study of nutraceutical nutricosmetics and cosmeceutical potentials of polyphenolic bark extracts from Canadian forest species. PharmaNutrition, 1: 158-167. 2013.
26. Ryu SY, Choi SU, Lee CO, Ahn JW, Zee OP. Antitumor activity of some phenolic components in plants. Archives of Pharmacal Research 17: 42-44. 1994.
27. Salla S, Sunkara R, Ogutu S, Walker LT, Verghese M. Antioxidant activity of papaya seed extracts against H2O2 induced oxidative stress in HepG2 cells. LWT-Food Science and Technology 66: 293-297. 2016.
28. Shunying Z, Yang Y, Huaidong Y, Yue Y, Guolin Z. Chemical composition and antimicrobial activity of the essential oils of Chrysanthemum indicum. Journal of Ethnopharmacology 96: 151-158. 2005.
29. Wang JS, Zhou J, Kong LY. Three new germacrane-type sesquiterpene stereoisomers from the flowers of Chrysanthemum indicum. Fitoterapia 83: 1675-1679. 2012.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||