Echinacea angustifolia 열수 추출물의 항산화, 항염 효과
The Antioxidant and Anti-inflammatory Activities of Echinacea angustifolia Hot Water Extract
狭叶松果菊热水提取物的抗氧化和抗炎活性
Article information
Abstract
목적
본 연구에서는 Echinacea angustifolia (E. angustifolia)열수 추출물의 화장품 원료로서의 기능성을 확인하기 위해 항산화능 및 항염활성을 측정하였다.
방법
라디컬 소거능으로서 DPPH, ABTS, FRAP 실험, 항산화 물질 측정으로서 폴리페놀과 플라보노이드 농도 측정을 실시하였다. 또한, 세포실험에서는 RAW 264.7 cell을 사용하여 세포독성 실험과 항염 실험을 실시하였다.
결과
실험결과 DPPH 실험에서는 ascorbic acid와 비교 시 27.98%의 항산화능을 나타내었으며, ABTS 실험에서는 ascorbic acid와 비교 시 20.29%의 항산화능을 나타내었다. FRAP에서는 E. angustifolia 추출물의 1 mg이 ascorbic acid 0.412±0.013 μg의 환원력을 보였다. 폴리페놀 농도는 104.42±3.21 mg/g으로 나타났으며, 플라보노이드 농도는 62.86±2.26 mg/g으로 나타났다. 세포실험결과 세포독성의 경우 80% 이상의 세포가 생존하여 E. angustifolia 추출물이 낮은 독성을 가지고 있음을 확인하였다. 한편 항염 활성 실험에서도 농도에 따라 염증반응을 감소시키는 동시에 200 μg/mL 농도에서 51.07±4.58%의 염증 억제능을 보였다.
결론
E. angustifolia 추출물의 코스메슈티컬 원료로서의 가능성을 확인할 수 있었다.
Trans Abstract
Purpose
This study attempted to investigate the antioxidant and anti-inflammatory effects of Echinacea angustifolia extract.
Methods
For analysis of radical scavenging activities, DPPH, ABTS and FRAP were performed. To analyze antioxidant properties, in addition, polyphenol and flavonoid concentrations were measured. In cell-based assays, cytotoxicity and anti-inflammatory assays were performed, using RAW 264.7.
Results
The results found the followings: DPPH and ABTS assays revealed 27.98% and 20.29% respectively in terms of antioxidant activities when compared to ascorbic acid. In the FRAP assay, E. angustifolia extract (1 mg) showed 0.412±0.013 μg of reducing power (ascorbic acid). Polyphenol and flavonoid concentrations were 104.42±3.21 mg/g and 62.86±2.26 mg/g each. In terms of cytotoxicity, more than 80% cells survived after the assays, confirming the low toxicity of E. angustifolia extract. In anti-inflammatory activities, the extract reduced the inflammatory response and, at the same time, showed 51.07±4.58% inflammation-inhibiting effects at 200 μg/mL, confirming the potential of E. angustifolia extract as an ingredient of cosmeceuticals.
Conclusion
These results confirmed the potential of E. angustifolia extract as an ingredient of cosmeceuticals.
Trans Abstract
目的
本研究试图研究狭叶松果菊(Echinacea angustifolia, E. angustifolia)提取物的抗氧化和抗炎作用。
方法
为了分析自由基清除活性, 进行了 DPPH、ABTS和FRAP。此外, 为了分析抗氧化特性, 还测量了多酚和类黄酮的浓度。在基于细胞的测定中, 使用RAW 264.7 进行细胞毒性和抗炎测定。
结果
与ascorbic acid相比, DPPH和ABTS的抗氧化活性分别高出27.98%和20.29%。在FRAP测定中, E. angustifolia 提取物 (1mg) 显示出0.412±0.013 μg的还原能力(抗坏血酸)。多酚和类黄酮浓度分别为104.42±3.21 mg/g和 62.86±2.26 mg/g。细胞毒性检测后, 发现超过80%的细胞存活, 证实了E. angustifolia提取物的低毒性。在抗炎活性方面, 该提取物降低了炎症反应, 同时在200 μg/mL时, 显示出51.07±4.58%的炎症抑制作用, 证实了E. angustifolia提取物作为药妆品成分的潜力。
结论
这些结果证实了E. angustifolia提取物作为药妆品成分的潜力。
Introduction
최근 합성 항산화제가 인체에 심각한 부작용을 일으킬 수 있다고 보고됨에 따라 천연소재로부터 분리된 다양한 활성 성분에 대한 연구가 활발히 수행되고 있다(Bilal et al., 2020). 다양한 식물의 활성 성분은 기존의 합성 소재보다 유해 성분에 대한 위험성 문제가 적으며, 인체에 효과적인 생리활성을 가지고 있어 기능성 화장품 소재로도 주목을 받고 있다.
현재 천연 항산화제로는 ascorbic acid, carotenoids, flavonoids, tannin, -tocopherol, vitamin C등이 알려져 있으며(Lee & Park, 2022), 이러한 식물유래 성분은 피부세포에 자유 라디칼(free radical)과 활성산소종(reactive oxygen species, ROS)의 생성을 억제 또는 제거시켜 산화에 의한 손상을 방지하는 역할을 한다(Lee et al., 2017; Lee & Kim, 2021). 산화에 의한 손상은 주로 superoxide anion (O2-), hydrogen peroxide (H2O2), hydroxyl radical (OH-), singlet oxygen (O2) 등의 ROS에 의해 발생하며(Thannickal & Fanburg, 2000), 이러한 ROS 증가는 피부의 형태학적 및 화학적인 변화를 유발시켜 염증을 촉진시킨다(Zhou et al., 2003).
염증(inflammation)은 우리 인체에서 가장 흔히 발생하는 질환으로서, virus나 bacteria와 같은 병원균의 침입을 인지한 면역세포가 생체를 보호하기 위해 일어나는 방어 기전 중의 하나이다(Cho et al., 2009; Kim et al., 2013, Lee et al., 2015; Kang & Ryu, 2021). 즉 염증반응은 유해한 자극에 대한 면역세포, 혈관, 염증 매개체들이 관여하는 보호반응(protective reaction)이며, 대식세포(macrophage)는 이런 염증반응에서 중요한 역할을 하고 있다(Yun et al., 2008). Lipopolysaccharide (LPS)로 활성화시킨 RAW 264.7 대식세포는 항염증 소재를 탐색하는 방법으로 현재까지 널리 사용되고 있으며, LPS에 의해 염증을 매개하는 물질로는 nitric oxide (NO), cyclooxygenase (COX), prostaglandin (PG), tumor necrosis factor-α (TNF-α), interleukin (IL) 등이 있다(Gilroy et al., 2004). 대식세포가 염증 유발물질인 lLPS의 자극받게 되면 inducible nitric oxide synthase (iNOS), cyclooxygenase-2 (COX-2) 및 cytokine과 같은 염증 매개체들의 분비를 촉진시켜 leukotriene, prostaglandin 및 nitric oxide (NO)를 생성시키면서 inflammatory reaction에 관여한다(Huang et al., 2005; Ko et al., 2017). 이러한 cytokine들은 피부 각질 형성 세포의 증식 속도를 감소시킬 뿐 아니라 진피층의 기질 형성을 방해하게 된다. 따라서 손상된 피부의 치유 속도를 감소시켜 피부의 노화, 아토피성 피부염, 건성 등과 같은 피부질환을 일으키게 된다(Kwon et al., 2011).
이처럼 일련의 산화반응과 염증반응은 밀접한 관련이 있으며(Kageyama & Waditee-Sirisattha, 2019), 연쇄적 산화반응을 감소시켜줄 수 있는 항산화 물질은 염증 또한 감소시키므로 생체 노화를 억제하기 위해서는 항산화 물질의 개발이 중요하다고 할 수 있다.
일반적으로 Echinacea는 미국 동부 중부와 캐나다 남부에 자연적으로 분포하며, 역사적으로 미국 북미에서 다양한 유형의 감염 및 상처 치료에 사용되는 전통식물 약재로 사용되어진 바 있다(Lienert et al., 1998). Echinacea 속에는 E. angustifolia, E. atroriibens, E. laevigata, E. pallida, E. paradoxa, E. purpurea, E. tennesseensis등이 알려져 있으며 E. pallicia, E. purpurea, E. angustifolia가 가장 많이 이용된다.
현재까지 Echinacea에 대해 수행된 화학적 약리학적 분석으로 chlorogenic acid, alkylamides 및 antiviral, anticancer activity, immunomodulatory effect등과 관련이 있음을 밝힌 바 있으며(Chicca et al., 2007; Pellati et al., 2011; Kumar & Ramaiah, 2011; Dogan et al., 2014), 관련 연구들이 활발하게 진행되고 있다. Echinacea 추출물의 불안 완화 및 우울증 향상 효과에 대한 연구(Lopresti & Smith, 2021), 알콜성 간 손상 예방에 관한 연구(Jiang et al., 2021), SARS-CoV-2에 의해 유발되는 호흡기 질환인 COVID-19에 관한 연구(Aucoin et al., 2021)등 의약품 및 식품 소재에 이르기까지 Echinacea의 활용가치가 높아지고 있다.
그러나 Echinacea의 다양한 연구 보고에도 불구하고, 화장품 소재로서의 연구는 부족한 실정이다. 따라서 본 연구에서는 E. angustifolia 추출물의 항산화와 항염활성 효과를 확인하여 기능성 화장품 산업의 소재로서의 이용 가능성을 알아보고자 한다.
Methods
1. 추출물
E. angustifolia는 열수 추출(hot water, HE) 방식을 이용하여, 정제수와 1%의 원물 비율로 80℃에서 유효성분 추출 후 정량을 통해 일정한 농도로 사용하였다. 동결건조 후 항산화능 실험은 70% ethanol을 용매로 재용해시켜 실험을 진행하였다. 세포실험은 dimethyl sulfoxide (DMSO; Sigma, USA)를 용매로 재용해 시킨 뒤 원심분리기(3000×G, 15 min)로 불용성 성분을 제거하고 본 실험에 사용하였다.
2. DPPH 라디칼 소거능 측정
E. angustifolia 추출물의 DPPH 라디칼 소거능 측정을 위해 2,2-diphenyl-1-picrylhydrazyl radical (DPPH)을 이용하여 측정하였다(Blois, 1958). 실험에는 ethanol 70%를 용매로 1% (w/v) DPPH 용액을 제조하여 사용하였으며, filter paper를 이용해 불용된 DPPH를 제거 후 다시 희석된 sample을 사용하였다. DPPH 용액 1.0 mL와 800 μg/mL를 기준으로 2 배씩 희석된 E. angustifolia 추출물 1.0 mL를 혼합하고, 30 min 간 반응시킨 후 UV-Vis Spectrophotometer (Ultrospec 3100 pro; GE Healthcare, USA)를 이용해 520 nm에서의 흡광도를 측정하였다. 실험결과는 환원된 DPPH 용액 및 추출물의 측정된 흡광도를 제외하고, ascorbic acid의 EC50을 측정한 후 비교하여 작성하였다.
3. ABTS 라디칼 소거능 측정
ABTS assay 측정은 potassium persulfate와의 반응에 의해 생성되는 ABTS free radical이 항산화제에 의해 소거되어 radical 특유의 색인 청색이 사라지는 것을 이용하였다(Re et al., 1999). ABTS의 안전한 흡광도 값을 얻기 위해 증류수를 용매로 ABTS 용액을 7 mM로 녹이고, 이 후 녹인 2.45 mM potassium persulfate를 12 시간 동안 발색이 일어나도록 하였다. 발색이 끝난 ABTS 용액의 흡광도는 740 nm에서 0.7이 되도록 설정하였다. ABTS 용액 1.0 mL와 500 μg/mL를 기준으로 2 배씩 희석한 E. angustifolia 추출물 1.0 mL를 혼합하고, 30 min간 반응시킨 후 UV-Vis Spectrophotometer 이용해 740 nm에서의 흡광도를 측정하였다. 실험결과는 환원된 ABTS 용액 및 추출물의 흡광도를 제외하고, ascorbic acid의 EC50을 측정한 후 비교하여 작성하였다.
4. FRAP 측정
실험에는 0.5 mg/mL 농도로 희석한 E. angustifolia 추출물을 사용하였다. 일정한 pH 값을 얻기 위해 0.2 M sodium phosphate buffer (pH 6.6) 2.5 mL에 E. angustifolia 추출물 2.5 mL를 혼합하고, 그 후 10% potassium ferricyanide 2.5 ml를 첨가하여 50℃에서 20 min 동안 반응시켰다. 반응이 끝난 시료는 10% trichloroacetic acid (TCA) 2.5 mL를 넣은 뒤 원심분리(3000×G, 15 min)하여 침전물을 제거하였다. 추출물의 환원력 평가에는 침전물이 제거한 용액 1 mL와 0.1% ferric chloride 용액 0.2 mL를 혼합한 후 700 nm에서의 흡광도를 측정하였다. FRAP은 ascorbic acid를 기준으로 standard curve를 작성하였다.
5. 폴리페놀 함량 측정
폴리페놀 함량 측정은 Folin-Ciocâlteu reagent를 이용하여 기준 물질과 비교하는 방법으로 실시하였다(Pękal & Pyrzynska, 2014). E. angustifolia 추출물 1.0 mL에 증류수로 10 배 희석된 Folin-Ciocâlteu reagent 0.1 mL를 혼합한 뒤 실온에서 5 min간 반응시켰다. 이 후 1.0 mL의 CaCO3 (5%, w/v)를 주입하여 30 min간 반응시키고, 760 nm에서 흡광도를 측정하였다. 폴리페놀 농도는 gallic acid를 이용한 standard curve를 이용하여 환산하였다.
6. 플라보노이드 함량 측정
플라보노이드 함량 측정은 플라보노이드와 알루미늄 이온의 결합에 따른 발색 차이를 통해 측정하였다(Pękal & Pyrzynska, 2014). E. angustifolia 추출물 1.0 mL에 NaNO2 (5%, w/v) 0.3 mL를 첨가 후 실온에서 5 min간 반응시켰다. 이 후 AlCl3 (2%, w/v) 0.5 mL를 주입하여 6 min간 반응시키고, 1 M NaOH 0.5 mL를 첨가하여 중화한 후 510 nm에서의 흡광도를 측정하였다. 플라보노이드 농도는 quercetin을 기준으로 standard curve를 이용하여 작성하였다.
7. 세포 독성 측정
추출물에 대한 세포독성 실험에는 RAW 264.7 cell을 사용하였으며, 측정에는 MTT assay를 실시하였다. 세포 배양에는 Dulbecco's Modified Eagle Medium (DMEM; GE healthcare, USA) 배지를 사용하였고, fetal bovine serum (FBS; Sigma) 10%를 첨가하여 제조하였다. 항생물질로는 Penicillin-Streptomycin (100X) (Sigma)을 사용하였다. DMSO에 용해시켜 처리한 E. angustifolia 추출물에 RAW 264.7을 96 well plate에 well 당 1×104 cell을 주입하여 24 시간 배양하였다. 배양 끝난 후 상층액을 제거하고 200 μg/mL를 기준으로 처리한 다양한 농도의 E. angustifolia 추출물을 48 시간 동안 배양하였다. 그 후 상층액을 제거하고 MTT용액 5 mg/mL를 첨가한 뒤 농도 5%의 CO2와 온도 37℃의 환경에서 결정화 시켰다. 각 well에 생성되어 있는 결정이 손상되지 않도록 상층액을 제거한 뒤 결정을 DMSO로 녹여 540 nm 파장에서 흡광도를 측정하였다.
8. NO 생성 억제능 측정
NO 생성 억제능 실험을 위해 RAW 264.7 cell을 사용하였으며, 세포의 배양에는 세포 독성 측정과 동일한 배양액을 사용하였다. 항생물질로는 Penicillin-Streptomycin (100X) (Sigma)을 사용하였고, E. angustifolia 추출물은 DMSO에 용해시켜 처리하였다. E. angustifolia의 NO 측정을 위해 RAW 264.7을 96 well plate에 well 당 1×104 cell을 농도로 seeding 하였으며, 온도 37℃, 5% CO2 조건에서 1일간 세포를 배양하였다. 배양이 끝난 후 상층액을 제거한 뒤 E. angustifolia 추출물 100 μg/mL를 기준으로 다양한 농도로 처리 후 LPS (Sigma)의 농도가 1 μg/mL가 되도록 처리하여 48 시간 동안 배양하였다. 그 후 상층액을 회수하여 Griess reagent 100 μL와 상층액 100 μL를 혼합하여 E. angustifolia 추출물 및 대조군 배양 상층액의 NO 농도를 측정하였다.
Results and Discussion
1. DPPH 라디칼 소거능
Figure 1은 E. angustifolia 추출물의 DPPH 라디칼 소거능을 계산한 결과이며, 실험 전 비교 대상으로 사용된 ascorbic acid의 EC50 수치를 측정하였다. 각 농도를 25-200 μg/mL 농도 범위로 반응시켜 ascorbic acid의 EC50 수치는 20.87 μg/mL임을 확인했다(Alexander et al., 1999).
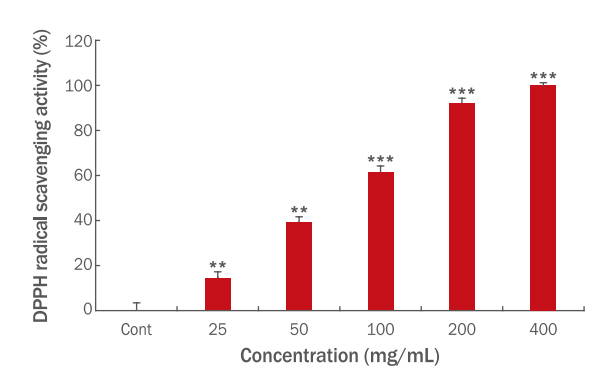
DPPH radical scavenging activity of Echinacea angustifolia extract.
DPPH solutions were treated with varying concentrations of E. angustifolia. Values represent the M±S.D. of three independent experiments (**p<0.01, ***p<0.001).
실험 결과 400 μg/mL 농도에서 100.00±0.97%, 200 μg/mL 농도에서 91.87±2.28%, 100 μg/mL 농도에서 61.21±2.65%, 50 μg/mL 농도에서 39.14±2.43%, 25 μg/mL농도에서 14.52±2.54%의 DPPH 라디칼 소거능이 나타났다. 한편 이를 바탕으로 EC50을 계산한 결과 ascorbic acid는 20.87 μg/mL, 본 추출물은 70.60 μg/mL로 나타나 ascorbic acid와 비교 시 약 27.98%의 항산화능을 보였다.
2. ABTS 라디칼 소거능
E. angustifolia 추출물의 ABTS 라디칼 소거능을 계산한 결과는 Figure 2와 같으며, 실험 전 비교대상으로 사용된 ascorbic acid의 EC50 수치를 측정하였다. 각 농도를 25-200 μg/mL 농도 범위로 반응시킨 ascorbic acid의 EC50 수치는 20.11 μg/mL임을 확인했다.

ABTS radical scavenging activity of Echinacea angustifolia extract.
ABTS solutions were treated with varying concentrations of E. angustifolia. Values represent the M ± S.D. of three independent experiments (*p<0.05, **p<0.01, ***p<0.001).
실험 결과 400 μg/mL에서 99.00±0.36%, 200 μg/mL에서 94.03±1.06%, 100 μg/mL에서 50.60±2.95%, 50 μg/mL에서 16.28±1.16%, 25 μg/mL에서 6.18±0.52%의 ABTS 라디칼 소거능이 나타났다. EC50 계산 결과 ascorbic acid의 수치는 20.11 μg/mL, 본 추출물은 99.11 μg/mL로 나타나 ascorbic acid와 비교 시 약 20.29% 항산화능을 보였다.
DPPH와 ABTS는 모두 안정적인 자유 라디칼로, 라디칼 활성이 있는 상태에서는 DPPH는 보라색, ABTS는 청록색을 나타내며, 항산화 물질에 의해 라디칼 활성이 소거된 경우 특유의 색과 흡광도가 사라진다(Blois, 1958; Re et al., 1999). 이 둘은 유사한 기전으로 반응하기 때문에 높은 상관관계를 나타내지만(Floegel et al., 2011), 항산화 물질의 구조 및 용해도, 시약의 분자 구조적 특징에 의해 다른 수치를 나타내기도 하며, 그 예로 폴리페놀의 경우 DPPH보다 ABTS와의 상관관계가 더 높게 나타난다(Sánchez et al., 2007). 이러한 이유로 두 실험을 종합적으로 평가하게 된다.
이에 본 연구에서 DPPH와 ABTS 실험 방법을 통해 얻어진 EC50 값은 각각 70.60 μg/mL, 99.11 μg/mL로 DPPH에서의 항산화능이 더욱 높게 나타났으며, E. angustifolia의 메탄올 추출물이 211 μg/mL의 EC50 값에 비해 더욱 강한 항산화능을 나타내었다(Sharifi-Rad et al., 2018).
3. FRAP
E. angustifolia 추출물과 ascorbic acid의 FRAP는 철 이온의 환원력을 이용하여 측정 비교하였다. E. angustifolia 추출물의 FRAP 측정 결과 0.166±0.005로 나타났으며, ascorbic acid의 standard curve를 바탕으로 E. angustifolia 추출물의 1 mg의 FRAP은 ascorbic acid 0.421±0.013 μg의 FRAP과 같음을 알 수 있었다.
4. Polyphenol 및 flavonoid 함량
Table 1은 E. angustifolia 추출물의 폴리페놀 함량과 플라보노이드 함량을 계산한 결과이다. 폴리페놀의 경우 104.42±3.21 μg/mL으로 나타났으며, 플라보노이드의 경우 62.86±2.26 μg/mL으로 나타났다.
Echinacea spp.의 경우 대표적인 유효성분으로 caffeic acid와 그의 유도체인 cynarin등이 존재하며, flavonoid에는 kaempferol과 그 유도체인 nicotiflorin 이 존재한다(Sharifi-Rad et al., 2018). 특히 flavonoid의 경우 금속과 반응하여 결합하는 특성을 지니고 있어(Korkina & Afanas' Ev, 1996), FRAP의 경우 flavonoid와 높은 관련성을 지닐 수 있다.
5. 세포 독성
E. angustifolia 추출물이 세포에 미치는 독성을 확인하기 위해서 MTT assay를 이용하여 세포 생존율을 측정하였다. E. angustifolia 추출물은 배지에서의 최종 농도가 12.5-200 μg/mL가 되도록 배합하여 배양을 진행하였다.
실험 결과는 Table 2와 같으며 200 μg/mL 농도에서 95.32±1.75%, 100 μg/mL 농도에서 94.75±2.17%, 50 μg/mL 농도에서 96.37±1.39%, 25 μg/mL 농도에서 97.58±1.91%, 12.5 μg/mL 농도에서 98.97±1.29%의 세포 생존율이 나타났다.
식품의약품안전처 고시 제2014-115호와 ISO 10993-5의 기준에 따르면, 실험결과 20% 이상의 세포 독성이 확인되었을 때 독성이 있는 것으로 간주한다. 이러한 기준에 따라 모든 실험 농도에서 세포독성이 나타나지 않은 것으로 확인되었다.
6. NO 생성 억제능
E. angustifolia 추출물이 macrophage의 염증반응에 미치는 영향을 확인하기 위해 griess reagent로 NO 생성량 측정 후 염증반응의 감소율을 측정하였다. E. angustifolia 추출물은 배지에서의 최종농도가 12.5-200 μg/mL가 되도록 배합하여 배양을 진행하였다.
Table 3은 염증과 관련된 지표인 NO의 감소율을 계산한 결과이다. 200 μg/mL에서 51.07±4.58%, 100 μg/mL에서 38.20±3.79%, 50 μg/mL에서 17.17±3.98%, 25 μg/mL에서 12.02±2.65%, 12.5 μg/mL에서 0.43±2.19%의 염증 억제율이 나타났다.
E. angustifolia의 추출물에서 예상되는 대표적인 항염물질로는 전술한 caffeic acid와 그의 유도체들이 있다. Caffeic acid와 그 유도체의 경우 LPS로 유도된 염증에서 NO 생성을 억제할 뿐만 아니라, iNOS와 염증성 cytokine의 농도를 감소시켜 항염효과를 보였으며(Da Cunha et al., 2004), 본 실험에서도 해당 실험 조건과 유사한 조건을 이용하여 실험을 진행하였으며 선행연구과 유사하게 염증을 억제하는 효과를 나타내었다.
Conclusion
본 연구에서는 열수 추출 방식을 이용한 E. angustifolia 추출물이 화장품 원료로서 효능을 확인하기 위하여 4 종의 항산화능 실험과 항염능 실험, 세포독성 실험을 실시하였다. DPPH 실험에서는 ascorbic acid 와 비교 시 약 27.98%의 항산화능을 보였으며, ABTS 실험에서는 ascorbic acid 와 비교 시 약 20.29%의 항산화능을 보였다. FRAP에서는 E. angustifolia 추출물 1 mg의 환원력과 ascorbic acid 0.412±0.013 μg의 환원력이 같음을 확인하였다. 폴리페놀 농도는 104.42±3.21 μg/mg 이었고, 플라보노이드 농도는 62.86±2.26 μg/mg 이었다.
세포 독성 실험과 항염활성을 측정한 세포실험에서는 실험 농도 범위에서 80% 이상의 세포가 생존하여 E. angustifolia 추출물이 낮은 독성을 가지고 있음을 확인할 수 있었다. 또한 항염활성 실험에서도 농도에 따라 염증반응을 감소시키는 동시에 200 μg/mL에서 51.07±4.58%의 염증 억제능이 있는 것으로 확인되었다.
이러한 결과를 종합해 볼 때, E. angustifolia 추출물은 천연 항산화제뿐만 아니라 항염 물질로서 피부노화 및 피부질환 등을 개선할 수 있는 기능성화장품 소재로서의 활용 가능성이 높음을 시사한다.
Notes
Author's contribution
IJC designed, performed experiments, analyzed data, and wrote the manuscript. All figures are created by the author.
Author details
In-Jeong Choi (Researcher), meeth R&D Institute, 7 Bongeunsa-ro 84-gil, Gangnam-gu, Seoul 06163, Korea.


