Aloe vera 부정근에서 추출한 phyto DNA를 포함하는 양이온 및 미네랄 복합물의 in vitro 항산화효과와 in vivo 피부장벽강화 효과
Efficacy in vitro Antioxidation and in vivo Skin Barrier Recovery of Composition Containing Mineral-cation-phyto DNA Extracted from Aloe vera Adventitious Root
含有从芦荟不定根提取的矿物-阳离子-植物DNA的组合物的体外抗氧化和体内皮肤屏障恢复功效
Article information
Abstract
목적
본 연구는 알로에 베라 부정근으로부터 추출한 피토 DNA를 추출하고 이를 포함하는 조성물을 통해 청색광으로 인한 피부 노화를 방지하고 피부장벽을 개선하고 재생시키는 효과를 확인하고자 하였다.
방법
피토 DNA를 추출하여 PLL (Polylysine)과 PAMAM (Poly(amidoamine))을 포함하는 복합체를 만들었다. 섬유아세포에서 DPPH법을 통해 항산화활성을 확인하였다. 청색광을 조사한 이후 MTT assay를 수행하였다. 다양한 비율의 미네랄 복합물을 더하여 제조한 피토 DNA과 양이온 중합체 및 미네랄 복합물의 복합물을 형성하여 HaCaT 세포의 청색광 조사 이후 세포 생장을 관찰하고 SOD1, FLG, LOR, COL1A1, MMP1의 발현을 RT-PCR로 측정하였다. HaCaT cell로 wound healing assay를 실행하여 세포재생효과를 확인하였다. 피토 DNA와 양이온 중합체, 미네랄 복합물을 포함하는 크림제형을 제조하였다. 태핑 스트리핑 방법(taping stripping method)을 이용한 인체적용 실험을 통해 표피 수분 손실량을 측정하였다.
결과
추출한 피토 DNA의 크기는 10 Kb였다. 양이온 중합체 및 피토 DNA복합물의 0.85%의 농도에서 섬유아세포는 100% 생존하여 독성이 없었다. 또 0.1%의 농도에서 항산화 효과가 93%로 0.05% 농도의 아스코르브산의 효과와 3%p 이하의 차이를 보였다. 청색광 조사 이후 피토 DNA 복합물의 농도가 증가할수록 섬유아세포의 생존율이 증가하였으며 농도가 100 μg/mL일 때 80.5% 세포가 생존하였고 모든 경우에서 아스코르브산의 경우와 7%p 이하의 차이를 보였다. 미네랄, 양이온 중합체, 피토 DNA를 포함하는 복합물을 처리한 HaCaT cell의 청색광 조사 이후에도 세포주기가 정상적으로 작동되는 것을 관찰하였다. 피토 DNA과 양이온 중합체 및 미네랄 복합물에서 미네랄 복합물의 비율이 증가할수록 피부장벽인자들인 SOD1, FLG, LOR, COL1A1의 발현과 세포재생율이 증가하였고 미네랄 복합물과 피토 DNA복합물의 비율이 1:10인 경우에서 인자들의 가장 높은 발현과 함께 MMP1의 발현이 가장 억제되었다. 세포재생율은 대조군인 미네랄복합물의 단일의 경우와 비교했을 때 미네랄과 피토 DNA 복합물의 10:1의 비율에서 95.7%의 높은 재생율을 보였다.
결론
알로에 베라 부정근의 피토 DNA는 우수한 DPPH 라디칼 소거능을 가졌으며 청색광의 피부세포독성을 완화할 수 있는 효과를 가진다. 피토 DNA 및 양이온 중합체와 미네랄 복합물의 특정 비율 조성에서 상승작용을 통해 피부장벽인자들의 발현을 증가시켜 피부장벽 강화와 회복에 대한 효능을 가진다.
Trans Abstract
Purpose
This study aimed to extract phyto DNA from the adventitious root of Aloe vera and confirm its role in improving and regenerating skin and antiaging properties caused by blue light.
Methods
Phyto DNA was extracted and a complex containing polylysine and Poly (amidoamine) was made. The antioxidant activity was confirmed using the DPPH method. The MTT test was performed on fibroblasts. The expression of SOD1, FLG, LOR, COL1A1, and MMP1 was measured using RT–PCR after blue light irradiation on HaCaT cells. The wound-healing test was performed. A phyto DNA complex cream formulation was created. Using this method, skin epidermal water loss was determined after human application.
Results
At 0.85% of the cation polymer–phyto DNA complex concentration, 100% of fibroblasts survived. At 0.1% concentration, the antioxidant effect was 93%. After being exposed to blue light, only 40.4% of fibroblasts survived, but after being treated with a 100 μg/mL complex, 80.5% survived. At a mineral–cation-phyto DNA complex ratio of 10:1, the expression of skin barrier factors was highest. About 95.7% of HaCaT cells regenerated at 10:1 ratio of the mineral with phyto DNA complex in comparison to complex with only the minerals without phyto DNA.
Conclusion
Phyto DNA from aloe vera’s adventitious root has no cytotoxicity, has excellent DPPH free radical scavenging ability, and can mitigate blue light cytotoxicity. It can improve skin barrier function by increasing the expression of barrier factors via a synergistic action in a specific ratio composition of phyto DNA, cationic polymer, and mineral complexes.
Trans Abstract
目的
本研究旨在从芦荟不定根中提取植物DNA,并证实其在改善和再生皮肤以及蓝光引起的抗衰老特性方面的作用。
方法
提取植物DNA并制备含有聚赖氨酸和聚酰胺胺的复合物。使用DPPH方法确认抗氧化活性。对成纤维细胞进行MTT测试。HaCaT细胞蓝光照射后,使用RT-PCR测量SOD1、FLG、LOR、COL1A1和MMP1的表达。使用 HaCaT细胞进行伤口愈合实验,以确认细胞再生效果。制备了含有植物DNA、阳离子聚合物和矿物质复合物的乳膏制剂。通过人体应用实验,采用敲击剥离法测量表皮失水量。
结果
在0.85%的阳离子聚合物-植物DNA复合物浓度下,100%的成纤维细胞存活。在0.1%浓度下,抗氧化效果为93%。暴露于蓝光后,只有40.4%的成纤维细胞存活,但用100 μg/mL复合物处理后,80.5%存活。当矿物质-阳离子-植物DNA复合物比例为 10:1时,皮肤屏障因子的表达最高。与仅含有不含植物 DNA的矿物质的复合物相比,含有植物DNA 复合物的矿物质比例为10:1时,约95.7%的HaCaT细胞再生。
结论
芦荟不定根植物DNA无细胞毒性,具有优异的DPPH自由基清除能力,并能减轻蓝光细胞毒性。它可以通过植物DNA、阳离子聚合物和矿物质复合物的特定比例组合物的协同作用,增加屏障因子的表达,从而改善皮肤屏障功能。
Introduction
알로에(Aloe genus)는 백합과(Liliaceae)속에 속하는 식물로 다년생 상록 다육질 초본으로 분류되며, 전 세계적으로 약 500 여종이 존재하는데(Cho et al., 2014) 그중 미국의 폴로리다와 텍사스, 뉴멕시코를 중심으로 대량 재배되는 알로에 베라(Aloe vera)는 오랫동안 효능이 연구되어 왔다. 한국에서는 1976년부터 김정문알로에가 처음으로 알로에 재배법을 개발하여 알로에 베라가 제주도 등지에 보급되어 재배되고 있다. 알로에 추출물은 당단백, 다당체 등의 저분자 물질인 안트라퀴논(anthraquinone)류, 안트론(anthrone)류, 크로몬(chromone)류, 피론(pyrone)류, 아미노산, 비타민과 미네랄 등의 성분들이 포함되어 있다고 알려져 있어 강한 항산화 작용과 항균항염 작용, 피부 세포재생, 상처치유, 자외선으로부터의 피부 보호, 피부 보습효과 등의 효과가 있다고 보고되었다(Rodrigues et al., 2018; Sánchez et al., 2020). 그 밖에 알로에 젤 추출물은 섬유모 세포의 성장을 촉진시키고 재생조직의 탄력성을 증가시키며 콜라겐 분해 및 재생을 촉진시킨다(Ro et al., 2000).
부정근은 정상위치가 아닌 잎과 줄기 같은 곳에서 발생되는 뿌리는 말하는데(Esau, 1977), 다양한 약초로부터 부정근을 조직배양하여 대량생산을 통해 산림과 생태계를 보호하고 의학적으로 유용한 식물의 대사산물을 얻기 위한 연구는 꾸준히 진행되어왔다(Khanam et al., 2022; Lee & Ahn, 2022). 최근 알로에의 뿌리 추출물은 기존의 항생제와 함께 사용되어 피부감염에 항균작용의 효과를 가진다고 밝혀졌다(Arbab et al., 2021). 활발하게 연구되어 효능이 입증된 알로에 젤 추출물과는 달리 알로에의 부정근에 대한 연구는 많지 않다.
일반적으로 외부적 요인으로 인해 발생하는 피부 노화는 외인성 노화(extrinsic aging)이라고 하는데, 이는 햇빛의 자외선에 의해 일어나는 광노화(photoaging)를 주로 말한다. 유전적 요인이 결정하는 내인성 노화의 잔주름과 전조증과 달리 이 경우 거친 주름과 불규칙한 색소 침착 등과 같은 노화현상을 동반하기에 다양한 파장대의 자연광에 대한 피부노화에 관한 연구가 활발히 진행되었다(Krutmann et al., 2021). 최근의 연구에서는 자연광의 UV 뿐만 아니라 가시광선(400-740 nm) 영역의 파장 또한 matrix metalloproteases (MMP)-1와 MMP-9와 피부세포 외기질을 분해하는 효소의 활성을 유도하며(Schroeder et al., 2008), 특히 UV가 제외된 태양광에서 청색광(412, 419, 426 nm)은 각질세포와 내피세포의 증식을 감 소시키는 것으로 나타났다(Liebmann et al., 2010). 더 나아가서 일반적으로 전자기기에서 많이 방출되는 인공 광원의 청색광 또한 상피 세포의 미토콘드리아 DNA를 손상시키고 활성산소(reactive oxygen species, ROS)를 생성하여, 세포 기능장애, 세포 노화 및 종양 발생을 야기한다고 보고되었다(Godley et al., 2005). 또한 태양의 자외선보다 더 깊은 피부 층에 침투하며, 피부 속 ROS의 생성을 유발하고 생성된 ROS는 피부노화를 유발하는 MMPs 효소의 발현을 활성화하는 등과 같은 청색광이 피부에 미치는 유해성에 대해 연구되고 있다(Kuse et al., 2014). 본 연구에서는 청색광으로 의한 피부노화를 방지하고 피부장벽을 개선하기 위한 성분으로 알로에 베라 부정근의 DNA에 대해 연구하였다.
일반적으로 연구되어진 연어의 polydeoxyribonucleotides (PDRN)은 크기가 50-1500 kDa인 데옥시리보오스 사슬이고 이들은 연어의 정소에서 추출되며 저분자화되어 adenosine A2A receptor를 활성화시켜 골생성, 항노화, 콜라겐 합성을 촉진한다(Kim et al., 2021a). 이와 비슷한 식물의 phyto DNA는 4종류의 염기인 퓨린과 피리미딘 염기로 이루어져 phosphodiester bonds의 결합으로 이루어진 데옥시리보오스 사슬의 식물의 고분자 DNA이다. 김(Porphyra sp.)에서 추출한 PDRN이 상처치유의 효과를 보였다는 연구보고가 있었으므로(Yang et al., 2021), 보고된 수산동물이외에서 식물 또한 DNA 추출재료가 되어 재생효과를 기대할 수 있으며 피부개선효과 또한 기대해볼 수 있다.
DNA와 폴리아미다민(poly(amidoamine), PAMAM) 덴드리머는 핵산의 음전하 인산기와 고분자의 양전하 아미노기 사이의 정전기적 상호작용에 의하여 복합체를 형성하여 DNA를 운반할 수 있다(Bielinska et al., 1999). 마찬가지로 DNA와 복합체를 형성할 수 있는 양이온의 폴리라이신(polylysine, PLL)은 플라스미드 DNA를 세포가 흡수할 수 있는 크기(<100-200 nm)로 압축할 수 있다(Zauner et al., 1998). 이러한 polycation들은 인체 세포에게 독성을 나타내지 않음과 동시에 DNA가 안정적이고 효과적으로 전달될 수 있는 운반체로 이용되고 있다(Bielinska et al., 1996; Pouton et al., 1998). 본 연구에서는 알로에 베라의 부정근으로부터 추출한 phyto DNA의 안정성을 높여 피부세포로의 전달 효율을 높이고자 하였다.
본 연구는 한국등록특허 제0133344호에 개시한 '알로에의 대량 증식방법'(Cho & Shim, 1994), 한국등록특허 제10-1576787호에 개시한 '안트라퀴논 화합물의 함량이 증가된 알로에 부정근의 제조 방법 및 상기 방법에 의해 제조된 알로에 부정근'(Yang et al., 2013), 한국등록특허 제10-1294742호에 개시한 '약리활성 물질이 증가된 알로에 부정근의 제조방법'(Yang et al., 2011)을 기반으로 한 식물 조직배양 기술에 의해 생산된 알로에 부정근으로부터 추출한 피토 DNA를 이용하여 PAMAM과 PLL을 포함하고 있는 양이온 중합체와 칼슘, 마그네슘, 칼륨, 나트륨, 아연을 포함하는 미네랄 복합물을 혼합한 복합물을 생성했다. 이 복합물을 통해 청색광으로 인한 피부노화를 방지하고 항산화, 피부 세포보호 및 재생, 피부장벽인자 발현 증가와 피부보습 효과를 확인하고자 했다.
Material and Methods
1. 재료
본 연구에서 사용한 알로에 베라(Aloe vera)는 3-5년 생육한 생잎으로 ㈜김정문알로에 제주 농공장으로부터 채취되었다(Kim et al., 2020a).
2. 알로에 베라 부정근 배양
알로에 베라 부정근의 배양은 대한민국 등록특허 제10-1576787호에 따라 준비되었다(Yang et al., 2013). 어린 알로에 베라 유묘의 잎을 흐르는 잎에 깨끗하게 세척하고 조직이 단단하고 옅은 노란색을 띄는 부분을 남기고 나머지 부분은 절단 후 4% chlorine bleach (Clorox, USA)에 담가 5 min 동안 교반 없이 표면 살균을 시켰다. 표면 살균이 끝난 후 멸균수로 수 회 표면 세척했다. 세척된 조직은 0.7 g/L 플레이트 아가(Sigma-Aldrich, USA)로 고형화된 0.5 mg/L NAA (1-Naphthaleneacetic acid)이 포함된 MS 배지(Murashige & Skoog, 1962) (Duchefas, 네덜란드)에 28℃ 암(dark) 상태에서 3주간 배양되었다. 유도된 부정근은 MS 배지에 0.3 mg/L indolil-3-butyric acid (IBA; Sigma-Aldrich)가 포함된 액체 배지로 옮겨 배양되었다.
3. 알로에 베라 부정근 조직배양의 피토 DNA 추출
알로에 베라 부정근으로부터 피토 DNA를 추출하기 위하여 먼저, 조직배양하여 수득한 알로에 베라 부정근 50-100 g을 채취하여 파쇄기로 얻은 파쇄액 30-50 mL를 원심분리하여, 알로에 베라 부정근의 세포를 수득하였다. 상기 수득한 알로에 베라 부정근의 세포에 800-1,000 μL 증류수 및 600-800 μL (pH 8.0) 페놀을 가하여 현탁시키고, 추가로 zirconia silica beads (0.5 mm, 0.4-0.8 g) (Inovatec Machinery, China)를 가하였다. 다음으로 100℃의 물과 액체 질소를 이용하여 상기 현탁액을 냉동 및 해동하는 과정을 3 회 반복 처리하였다. 처리 후 상기 동결 및 해동절차를 수행한 현탁액을 3,800-4,000 rpm 및 50-60 s의 조건으로 비드비팅 기계(BIOSPEC product, USA)에 적용하여 세포벽을 파쇄하였다.
상기 세포벽을 파쇄한 현탁액을 10,000 g에서 10-15 min 원심분리하고, 이로부터 상등액을 수득하였다. 상기 수득한 상등액에 6.0-10.0 mL의 chloroform (Sigma-Aldrich)을 가하고, 15 s 볼텍싱 (vortex)하여 격렬하게 교반한 다음, 다시 10,000 g에서 5-10 min 원심분리하고, 이로부터 상층액을 수득하였다.
상기 상층액에 동량의 이소프로필알코올(Sigma-Aldrich) 및 10% (v/v)의 3M 소디움아세테이트(Sigma-Aldrich)를 가하고, 서서히 혼합한 다음, -20℃에서 10-30 min 이상 보관 후 시료를 다시 10,000 g에서 5-10 min 원심분리하고, 상층액을 제거하였다. 다음으로 70% 에탄올(Sigma-Aldrich) 100-200 mL를 가하고 혼합한 후에 동일한 방법으로 10,000 g에서 5-10 min 원심분리하고, 상층액을 제거하였으며, 침전된 DNA 펠렛을 5-10 min 동안 진공건조시킨 다음, 멸균 증류수 1.0-1.5 mL 가하여 DNA를 용해시키고 수득하여 이를 -70℃에 보관하였다.
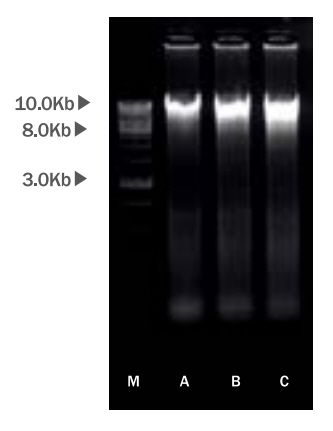
4. 전기영동
추출한 피토 DNA의 크기를 확인하기 위해서 전기영동을 실시하였다. 1X TAE buffer (Sigma-Aldrich)를 채워 EtBr (1:10000) (Sigma-Aldrich)을 첨가한 1% Agarose gel (GenDEPOT, USA)이 잠기도록 한 후 피토 DNA 10 μL에 6X Gel loading buffer (Sigma-Aldrich) 2 μL를 혼합하여 6 μL씩 로딩하였다. iVDye 1Kb DNA ladder (GenDEPOT, USA) 2 μL를 로딩하였다. 135V에서 30 min 로딩 후 gel을 빼내어 UV lamp (TN-4LC; Korea Ace Scientific, Korea)에서 확인하였다.
5. 복합물과 제형의 제조
1) 알로에 베라 부정근 조직배양의 피토 DNA 및 양이온 중합체 혼합물(이하, 알로에 베라 부정근의 조직배양 피토 DNA 복합물)의 제조(Sample 1)
양이온 중합체는 PLL (한스코리아, Korea) 및 PAMAM (Sigma-Aldrich)을 3:1로 혼합하여 사용하였다. 추출된 알로에 베라 부정근의 조직배양 피토 DNA와 양이온 중합체를 2:1의 중량비로 혼합하여 Sample 1를 제조하였다.
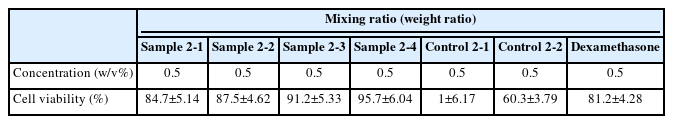
2) 알로에 베라 부정근의 조직배양 피토 DNA 복합물 및 미네랄 복합물을 혼합한 복합물의 제조(Sample 2-1~4, Control 2-1, 2)
미네랄 복합물을 제조하기 위한 원료는 한스코리아(HANSKOREA, Korea)로부터 공급받았다. 칼슘 5.0 ppm, 마그네슘 1.0 ppm, 칼륨 0.5 ppm, 나트륨 5.0 ppm 및 아연 2.0 ppm을 혼합하여 미네랄 복합물을 제조하였다. Method 5의 알로에 베라 부정근의 조직배양 피토 DNA 복합물 시료(Sample 1)에 미네랄 복합물을 Table 1과 같은 6 가지 비율로 혼합하여 복합물을 제조하였다. 이를 부틸렌글라이콜(ACTIVON, Korea)에 용해시킨 후, 천연 올리고당(Mirae biotech, Korea)을 첨가하여 육안으로 침전이 없는 상태가 될 때까지 안정화(약 5-10 min 소요)시켜 복합물(Sample 2)을 제조하였다.
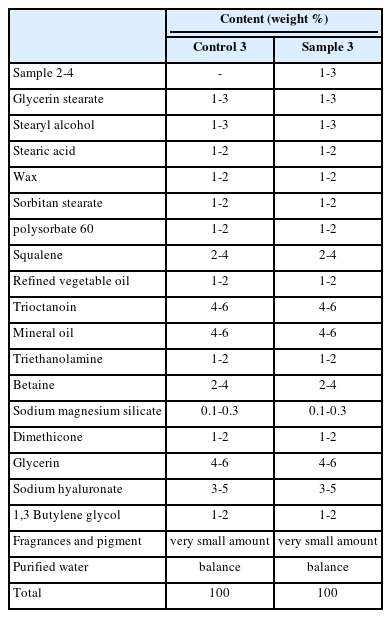
3) Method 5-B에서 제조한 복합물을 함유하는 크림 제조(Sample 3, Control 3)
본 Method 5-B에서 제조된 복합물 중 Sample 2-4 (1:10)의 복합물을 포함한 크림을 Table 2의 조성 및 함량으로 제조하였다. Table 2에서 미량의 함량은 0.1 중량% 이하를 의미하며 구체적으로 0.001-0.1 중량%이 포함된 것을 의미한다. 사용된 원료는 모두 옵트바이오(OPTBIO, Korea)에서 공급받았다.
6. In vitro assay
1) 섬유아세포에서의 독성 확인
서울대학교 의과대학 피부과 실험실에서 공급받은 사람 유래 섬유아세포 2×105 cells/well의 농도로 96 웰 플레이트(well plate)에 배양하고 10% fetal bovine serum (FBS; Sigma-Aldrich)를 함유하는 Iscove's Modified Dulbecco's Medium (IMDM; Sigma-Aldrich) 0.2 mL를 공급한 후 24 h 동안 CO2 배양기에서 배양하였다. 여기에 dimethyl sulfoxide (DMSO; Sigma-Aldrich)에 녹인 시료용액(Sample 1)을 처리한 다음 24 h 동안 배양하였다. 이후, 세포의 생존력을 알아보기 위하여 MTT assay를 수행하였다. MTT assay는 배양한 세포에 1-(4,5-Dimethylthiazol-2-yl)-3,5-diphenylformazan (MTT; Sigma-Aldrich) 용액 0.1 mL를 가한 후, 4 h 동안 배양한 다음 배지는 제거하고 DMSO 0.5 mL를 넣어 형성된 포마잔(MTT formazan)을 ELISA (enzyme-linked immunosorbent assay) (Sigma-Aldrich)를 사용하여 570 nm에서 흡광도를 측정하였다. 아래 식에 의해 세포생존율(%)을 측정하였으며, 세포의 생존에 영향을 미치지 않는 시료의 농도를 결정하였다.
세포생존율(%) = [(St-Bo/(Bt-Bo)]×100
Bo: 세포배양 배지만을 발색 반응한 웰의 570 nm 흡광도
Bt: 시료를 처리하지 않고 발색 반응한 웰의 570 nm 흡광도
St: 시료를 처리하고 발색 반응한 웰의 570 nm 흡광도
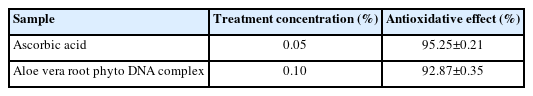
2) DPPH 라디칼 소거 활성능 측정
항산화 활성은 DPPH (1,1-diphenyl-2-picrylhydrazyl, Sigma-Aldrich)법을 이용하여 시료의 free radical 소거능을 측정하고자 하였다(Brand-Williams et al., 1995). 먼저, 다양한 농도의 추출물 1 mL에 4×10-4 M DPPH 용액 5 mL를 가하여 혼합한 다음 암소에서 30 min 반응시켜 ELISA (Sigma-Aldrich)를 이용하여 517 nm에서 흡광도를 측정하였다. 계산식은 다음과 같이 계산하였다(Kim et al., 2022).
DPPH radical scavenging activity (%)=100-[(OD of sample/OD of blank)×100]
3) 청색광 조사에 의한 세포 독성 완화 효과 측정
사람 유래 섬유아 세포 2×105 cells/well의 농도로 96 well plate에 배양하고 10% FBS를 함유하는 IMDM 배지 0.2 mL를 공급한 후 24 h 동안 CO2 배양기에서 배양하였다. 여기에 DMSO에 녹인 시료 용액(Sample 1)을 처리한 다음 450 nm의 청색광을 120 min 조사한 후 24 h 동안 배양하였다. 이후, 세포의 생존력을 알아보기 위하여 MTT assay를 수행하였다. MTT assay는 배양한 세포에 MTT 용액 0.1 mL을 가한 후 4 h 동안 배양한 다음 배지는 제거하고 DMSO 0.5 mL를 넣어 형성된 포마잔을 ELISA (Sigma-Aldrich)를 사용하여 570 nm에서 흡광도를 측정하였다. 대조물질로 ascorbic acid (Sigma-Aldrich)를 사용하였다.
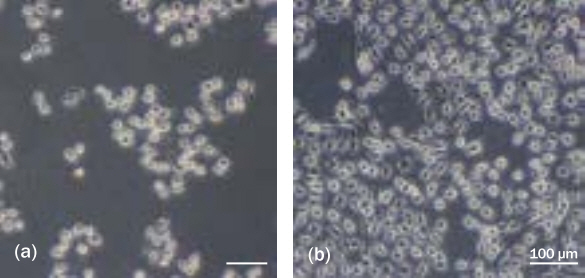
4) Method 5-B에 따른 복합물(Sample 2-4) 처리에 의한 세포 생장 효과 측정
본 Method 5-B에서 수득된 알로에 베라 부정근의 조직배양 피토 DNA 복합물 및 미네랄 복합물(Sample 2-1~4) 중, Sample 2-4 (1:10)의 복합물을 처리한 후 세포의 생장을 관찰하였다. 서울대학교 의과대학 피부과 실험실에서 공급받은 HaCaT 세포를 6 well plate에 1×106 cells/well의 농도로 분주하여 배양한 후, 10% FBS가 첨가된 배지로 교체하여 18 h 동안 결핍(starvation)시키고, 24 h 동안 배양하였다. HaCaT 세포에 시료 0.5 (w/v%)씩 처리한 다음 450 nm의 청색광을 120 min 조사한 후, 48 h 동안 배양하였다.
5) HaCaT cell cultivation and assay
HaCaT 세포를 6 well plate에 1×106 cells/well의 농도로 분주하여 배양한 후, FBS가 첨가되지 않은 배지로 교체하여 18 h 동안 starvation 시키고, 24 h 동안 배양하였다. HaCaT 세포에 각 시료 0.5 (w/v%)씩 처리한 다음 450 nm의 청색광을 120 min 조사한 후, 48 h 동안 배양하였다. 이후 세포는 reverse transcription polymerase chain reaction (RT-PCR)을 이용하여 각각의 발현량을 조사하였다.
(1) Method 5-B에 따른 복합물 처리에 대한 SOD 활성 효과 측정
항산화 효과를 측정하는 방법으로 superoxide dismutase (SOD) 활성 측정 시험을 수행하였다. 본 Method 5-B에서 제조된 Sample 2 및 Control 2 복합물에서의 SOD의 발현량을 측정하였다.
(2) 피부장벽 관련 인자 활성 효과 측정
본 Method 5-B에서 제조된 Sample 2-1~4 및 Control 2-1, 2 복합물의 피부장벽 강화 효과를 확인하기 위해 관련 유전자 FLG와 LOR의 활성을 측정하였다. 배양된 세포에서 RNA를 추출하여 RT-PCR을 통해 FLG와 LOR의 발현량을 조사하였다. 대조군으로 레티 노산(retinoic acid) (Sigma-Aldrich) 50 ppm을 사용하였다.
6) HDF (human dermal fibroblasts adult) cell cultivation and assay
섬유아세포(human dermal fibroblasts adult)를 10% LSGS가 첨가된 Human Fibroblast Expansion Basal Medium (Medium 106; Gibco, USA) 배지를 이용하여 1×106 cells/well로 조절한 후, 12 well plate에 접종하고 18 h 동안 배양하였다. 배양 후, 본 Method 5-B에서 제조된 Sample 2-1~4 및 Control 2-1,2 복합물의 각각의 시료를 0.5 (w/v%)씩 처리하고, 450 nm의 청색광을 120 min 조사한 후, 48 h 동안 배양하였다. 배양된 세포에서 RNA를 추출하여 RT-PCR을 통해 각각의 발현율을 확인하였다
(1) MMP-1 생성 억제 효과 측정
시료와 함께 배양된 HDF에서 RNA를 추출하여 RT-PCR을 통해 MMP1의 발현율을 확인하였다. 대조군으로는 아데노신(adenosine, Sigma-Aldrich) 50 ppm을 사용하였다. MMP1 발현율을 아래 식에 의하여 산출하였다.
MMP1 발현율(%)=(시료 MMP1 발현량/양성 대조군 MMP1 발현량)×100
(2) COLA1A1 발현 증가 평가
시료와 함께 배양된 HDF에서 RNA를 추출하여 RT-PCR을 통해 COLA1A1의 발현 증가율을 확인하였다. COLA1A1 발현 증가율을 하기 수학식에 의하여 산출하였다.
COLA1A1 발현율(%)=(시료의 COLA1A1 발현량/양성대조군 COLA1A1 발현량)×100
7) HaCaT cell 재생 효과
피부 재생 효과를 확인하기 위해 wound healing assay를 수행하였다. 각질형성세포(HaCaT)를 10% FBS가 첨가된 DMEM 배지를 이용하여 1×106 cells/well로 조절한 후, 6 well plate에 접종하고 18 h 동안 배양하였다. 6 well plate에 가득 자란 세포에 스크래치를 내어 세포의 일부분을 플레이트 바닥에서 떨어지게 한 다음, Sample 2 및 Control 2 각각의 시료를 0.5 (w/v%)씩 처리하여 48 h 동안 배양하였다. 세포가 재생된 정도를 확인하였고, 세포재생율을 하기 수학 식에 의하여 산출하였다. 대조군으로는 덱사메타손(dexamethasone, Sigma-Aldrich)을 사용하였다.
세포재생율(%)=(시료 세포 재생율/대조군 세포 재생율)×100
7. 인체 임상시험
1) 피부 보습 개선 효과 측정
건강한 피부를 가진 만 18세 이상의 여성 피험자 10명을 대상으로 4주간 인체적용시험을 진행하였다(시험기관: 피엔케이피부 임상연구센타㈜, 시험기간: 2019.09.05-09.10, IRB No. PNK-16905-M1R). 피부 보습에 대한 임상시험으로 피부 수분 측정기(Corneometer, Courage+Khazaka, GmbH, Germany)를 이용하여 피부전도도를 측정함으로써 피부 보습력을 평가하였다. 피부 수분 측정은 실내온도 20-25℃, 상대습도 40-55%로 유지시킨 항온항습 조건 하에서 본 Table 2의 각각의 두 크림을 10명의 피험자 얼굴을 반으로 나누어 한쪽에는 Sample 3의 크림을 다른 한쪽에는 Control 3의 크림을 도포(2 회/1 일)하여 사용 전 및 2 주 후의 수분 함유량을 측정하였다.
8. 통계처리
본 실험에서 진행된 각 실험군 간의 비교분석은 SPSS 21.0 프로그램(SPSS Inc., Chicago, USA)을 이용하여 Student's t-test (p value<0.05*, 0.01**, 0.001***)로 통계 처리하였다.
Results and Discussion
1. 알로에 베라 부정근 조직배양의 피토 DNA 추출
알로에 베라의 부정근을 조직배양하고 이로부터 피토 DNA를 추출하여 전기영동을 실행하였다. 피토 DNA의 크기는 약 10 Kb에서 형광의 밴드를 확인할 수 있었다(Figure 1). 겔에 혼합한 EtBr은 DNA 염기쌍 사이에 평평하게 끼어들어가 300 nm의 자외선에서 EtBr이 파장을 흡수하여 600 nm의 주황색 형광 가시광선을 발산하게 되므로(Vardevanyan et al., 2003) 추출한 시료가 DNA임을 확인하였다. 기타 식물(쑥갓, 겨자, 갯무, 공심채 등 10종)에서 유래된 PDRN을 9 min 동안 초음파 분쇄한 크기가 200-1200 bp 인 것을 고려하면 상당히 큰 수준이었다(Song et al., 2022). 이러한 크기는 알로에 베라의 피토 DNA를 추출하는 과정에서 초음파 분쇄과정은 없었기 때문이라고 사료된다. 그러나 알로에의 DNA가 12.93 Gbp인 것을 고려하면 저분자화 된 것을 알 수 있었다(Jaiswal et al., 2021). 저분자화된 피토 DNA에 대해 피부세포의 흡수를 기대할 수 있을 것이다.
2. In vitro results and discussion
1) 알로에 베라 부정근의 조직배양 피토 DNA 복합물의 세포 독성 확인
본 Method 5에서 양이온 중합체를 첨가하여 수득된 알로에 베라 부정근의 조직배양 피토 DNA 복합물(Sample 1) 시료 처리에 의한 피부 세포의 세포 독성을 확인하였다. Table 3에 나타낸 바와 같이, 알로에 베라 부정근의 조직배양 피토 DNA 복합물 시료에서 100% 세포생존농도가 0.85±0.21%로 대조군이 0.007±0.002%인 것에 비해 세포 독성이 낮아 피부 자극 유발 가능성이 낮고 안전한 것으로 확인되었다. 이와 유사하게 인간의 DNA 성분과 같은 길이 50-200 bp의 디옥시리보뉴틀레오타이드로 이루어진 송어의 정자에서 추출한 PDRN의 경우에서도 세포독성이 없고 항원성을 나타나지 않았으므로(Galeano et al., 2008) 피토 DNA 또한 인체적합성이 높은 것으로 사료된다. 이는 안전한 피부 기능성 조형물로써의 활용가능성을 시사한다.
2) 알로에 베라 부정근의 조직배양 피토 DNA 복합물(Sample 1)의 DPPH 라디칼 소거 활성능(항산화 활성) 측정
ROS로 인해 산화스트레스가 발생하면 멜라닌형성과 세포외기질 단백질들의 항상성에 영향을 주어 피부세포의 장애와 질환을 야기할 수 있다(Kim et al., 2020b). 항산화 활성은 피부건강에 효과를 줄 수 있으므로 본 Method 5에서 조합한 알로에 베라 부정근의 조직배양 피토 DNA 복합물의 DPPH 라디칼 소거능을 확인하고자 하였다. 대조군으로 아스코르브산(ascorbic acid)을 사용하였다.
Table 4에 나타낸 바와 같이, 0.1% 알로에 베라 부정근의 조직배양 피토 DNA 복합물 시료는 92.87±0.35%의 DPPH 라디칼 소거능을 보여주었고, 0.05%의 아스코르브산 대조군의 95.25±0.21%의 소거능을 확인하였다. 우수한 DPPH 라디칼 소거능이 나타났으므로 알로에 베라 부정근의 조직배양 피토 DNA 복합물이 항산화 활성을 가지는 것을 확인하였다. 연어의 정소에서 추출한 PDRN의 경우, 1000 μg/mL의 농도에서 Vit C의 소거능의 60%의 소거능을 보여주는 것을 고려하면(Kim et al., 2020b) 알로에 베라 부정근에서 추출한 피토 DNA의 소거능이 상당히 우수한 것을 알 수 있었다. 이러한 항산화 활성은 피부세포에서 멜라닌색소 침착을 저해하고 노화를 막는 효과를 지니고 있으므로(Rinnerthaler et al., 2015) 피부개선효과를 가진 기능성 원료로의 가능성을 제시할 수 있다. 또한 청색광은 피부세포로부터 ROS를 생성하고 이는 DNA를 영구적으로 손상시켜 피부노화에 기여하므로(Nakashima et al., 2017) 피토 DNA복합물의 항산화 활성을 통해 청색광으로 인해 발생한 ROS를 제거하여 독성완화의 효과도 기대해 볼 수 있다.
3) 알로에 베라 부정근의 조직배양 피토 DNA 복합물(Sample 1)의 청색광 조사에 의한 세포 독성 완화 효과 측정
일반적으로 전자기기에서 많이 방출되는 청색광은 피부세포에서 ROS를 생성하고 피부세포의 미토콘드리아의 산화스트레스를 유발하여 UV와 유사하게 피부노화와 주름생성에 영향을 준다는 연구보고가 있었다(Nakashima et al., 2017). 본 연구에서는 알로에 베라 피토 DNA가 피부세포의 청색광으로 인한 독성을 완화할 수 있는지 알아보고자 실험을 진행하였다. 120 min 청색광을 조사한 인체 섬유아세포에 알로에 베라 부정근의 조직배양 피토 DNA 복합물(Sample 1) 시료를 처리하여 생존율을 확인하였다. 초기 생존율 40.3%에서 대조군 아스코르브산과 마찬가지로 시료의 농도가 증가할수록 생존율이 증가하는 경향을 보였으며 시료의 농도가 1000 μg/mL일 때 80.5%의 우수한 생존율을 보였다(Table 5). 1000 μg/mL의 아스코르브산이 85.5%인 것을 고려하면 5%p이하의 차이로 우수한 독성완화의 효과를 가졌다. 모든 경우에서 대조군 아스코르브산과 비교하여 차이 7%p 이하로 비슷한 수준의 세포생존율을 보여주었다. 따라서 알로에 베라 부정근의 조직배양 피토 DNA 복합물(Sample 1) 시료는 청색광 조건에서 세포독성 완화에 대한 효능이 있는 것을 확인하여 기능성 원료의 가능성을 제시할 수 있다. 미디어와 친숙한 현대 사람들에게 앞으로 인체에 노출되는 청색광은 늘어날 것으로 보이며 피부를 보호하기위한 원료로써 알로에 베라의 피토 DNA가 청색광의 독성을 완화하는 역할을 수행할 수 있을 것으로 예상한다.
4) 미네랄 복합물을 포함한 알로에 베라 부정근의 조직배양 피토 DNA 복합물의 세포 생장 효과 측정
Method 5-B에서 제조한 알로에 베라 부정근의 조직배양 피토 DNA 복합물과 미네랄 복합물을 혼합한 복합물의 피부 각질 세포인 HaCaT cell에서의 생장효과를 확인하고자 실험을 진행하였다. Figure 2의 (a)는 Sample 2-4를 10% FBS 배지에 처리하고 450 nm 파장의 청색광을 조사한 직후의 세포 사진이고, (b)는 Sample 2-4의 복합물을 10% FBS 배지에 처리하고 450 nm 파장의 청색광을 조사한 후 48 h 배양한 후의 세포 사진이다. 세포 수가 48 h 만에 증가하였는데, 일반적인 HaCaT cell의 doubling time은 28 h 이므로(Pessina et al., 2001) 청색광 조사 이후 Sample 2-4의 처리로 세포 분열에 저해가 없음을 알 수 있다. Yoo et al. (2020)의 연구에서 30 min의 청색광 조사로 인해 피부각질세포의 분열이 유의미하게 감소한 것을 고려하면 복합물의 처리를 통해 각질세포가 cell cycle을 회복한 것으로 사료되었다.
5) 미네랄 복합물을 포함한 알로에 베라 부정근의 조직배양 피토 DNA 복합물의 SOD1 발현 촉진 효과 측정
Superoxide dismutases (SODs)는 인체의 metalloenzymes 중 하나로 superoxide anion free radical (O2-)을 산소 및 과산화수소(H2O2)로 분해하는 것을 촉매한다. 세포내 발생되는 ROS를 감소시켜 산화 스트레스를 줄이는 역할을 수행한다. 따라서 SOD는 피부 세포의 라디칼로 인한 손상을 줄일 수 있고 주름, 검버섯 등의 피부 노화를 예방하는 효능이 있어 노화방지제품의 항산화제로 사용된다(Younus, 2018). 본 연구에서는 상기의 Sample 1의 DPPH소거능을 확인하여 피토 DNA가 항산화 효능이 있음을 확인하였다. 또한 미네랄과 혼합한 복합물의 경우에서의 항산화 효과를 확인하고자 SOD1의 발현량을 측정하였다.
대조군으로 아스코르브산 50 ppm을 사용하였다. Figure 3(a)에 나타낸 바와 같이, 알로에 베라 부정근의 조직배양 피토 DNA 복합물 시료에 미네랄 복합물을 함께 포함하는 Sample 2-1~4의 복합물에서 미네랄 복합물의 비율이 증가함에 따라 발현량이 증가하였다. 특히, Sample 2-4의 미네랄 복합물과 피토 DNA 복합물의 비율이 10:1인 경우에서 가장 높은 SOD1의 발현을 확인했다. 또한 피토 DNA복합물 또는 미네랄 복합물을 단독으로 처리한 Control 2-1 및 2에 비하여 우수한 SOD1 발현을 보여주었다. 미네랄 복합물만 존재하는 Control 2-2의 경우, Sample 2-1인 미네랄 복합물과 피토 DNA의 비율이 1:1인 경우와 비슷한 수치의 발현량을 보였다. 이는 Sample 2-4의 높은 SOD1 발현 유도 효과가 미네랄 복합물만의 효과가 아닌 피토 DNA와의 특정한 비율 조성이 SOD1 발현을 우수하게 유도하는 것을 의미한다. 청색광은 피부세포에서 산화 스트레스를 유발하여 피부노화를 유도한다(Opländer et al., 2011). 따라서 앞서 Sample 1의 청색광에 의한 세포독성 완화 효과와 같이 Sample 2 또한 우수한 SOD1 활성으로 청색광에 의한 피부노화의 방지 효과가 있을 것으로 사료된다.
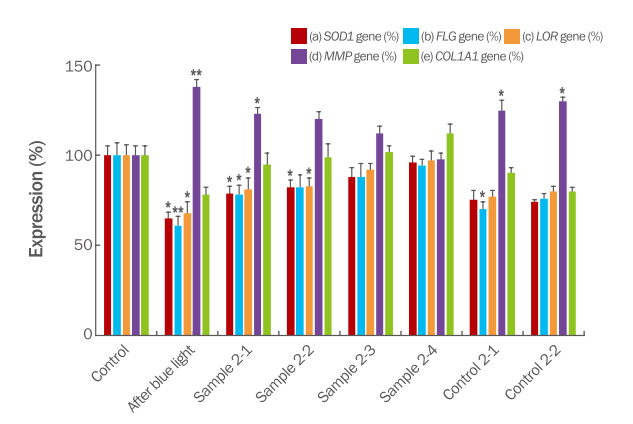
SOD1, FLG, LOR, MMP-1, and COL1A1 gene expression in HaCaT and HDF cell after Aloe vera root phyto DNA and mineral complex treatment.
The expression level of each gene was expressed relative to the control group as 100%. The after blue light means each gene expression after 450 nm blue light radiation for 120 min. The Sample 2-1, Sample 2-2, Sample 2-3, Sample 2-4, Control 2-1, and Control 2-2 are same complex of Table 1. Data are means of 3 separate experiments with S.D. (p value<0.05*, 0.01**, 0.001***) (a) SOD1 gene expression on HaCaT cell. The control is 50 ppm of ascorbic acid. (b) FLG gene expression on HaCaT cell. The control is retinoic acid. (c) LOR gene expression on HaCaT cell. The control is retinoic acid. (d) MMP-1 gene expression on HDF cell. The control is adenosine. (e) COL1A1 gene expression on HDF cell.
6) 미네랄 복합물을 포함한 알로에 베라 부정근의 조직배양 피토 DNA 복합물의 필라그린과 로리크린의 유전자의 발현 활성 효과 측정
필라그린(filaggrin)은 피부각질세포의 구조를 형성하는 단백질로 각질세포내에 존재하는 케라틴 섬유조직을 고정시키고 모이도록 한다. 이러한 네트워크는 피부의 물리적인 강도를 높여 피부장벽을 형성하는 데에 도움을 준다(Kim & Lim, 2021). 또한 필라그린은 피부 세포에서 천연보습인자(natural moisturizing factor, NMF)로 역할을 수행할 수 있기 때문에 이들의 결핍 혹은 불완전성은 외부의 물리적 스트레스에 대항하는 피부장벽의 붕괴와 수분불균형을 유발하여 아토피 피부염의 원인이 된다(Thyssen et al., 2014). 유사하게 피부 장벽의 주요한 인자인 로리크린(loricrin)은 피부 상피세포의 70%의 중량을 차지하는 단백질로 구조적 기능을 하며 피부의 수분과 이온의 손실을 방지하고 외부인자로부터 보호하는 역할을 수행한다(Koch et al., 2000). 필라그린과 로리크린의 다양한 비율의 복합물의 처리에 따른 발현량의 변화를 확인하기 위한 실험을 진행했다.
Figure 3의 (b) 및 (c)에 나타낸 바와 같이, 모든 경우 로리크린(LOR)이 필라그린(FLG)보다 높은 발현량을 보였다. 알로에 베라 부정근의 조직배양 피토 DNA 복합물과 미네랄 복합물을 함께 포함하는 Sample 2-1~4의 복합물에서 미네랄 복합물의 농도가 증가함에 따라 FLG과 LOR의 발현량이 각각 증가하는 것을 확인하였다. 특히, Sample 2-4의 미네랄 복합물과 피토 DNA 복합물의 비율이 10:1인 경우에서 두 인자 모두 가장 높은 발현을 확인했다. 또한 피토 DNA 복합물 또는 미네랄 복합물을 단독으로 처리한 Control 2-1 및 2에 비하여 우수한 발현을 보여주었다. 미네랄 복합물만 존재하는 Control 2-2의 경우, 두 인자 모두 Sample 2-1인 미네랄 복합물과 피토 DNA의 비율이 1:1인 경우와 비슷한 수치의 발현량을 보였다. 이는 Sample 2-4의 높은 FLG과 LOR의 발현 유도 효과가 미네랄 복합물만의 효과가 아닌 피토 DNA와의 특정한 비율 조성이 두 인자들의 발현을 우수하게 유도하는 것을 의미한다. 이는 퀴노아 추출물과 미네랄의 복합물이 각각의 미네랄 혹은 퀴노아 추출물의 경우보다 우수하게 두 피부장벽 인자들을 유도한 연구결과와 같은 메커니즘을 가질 것으로 사료된다(Lee et al., 2014). 따라서 미네랄 복합물과 알로에 베라 부정근의 조직배양 피토 DNA 복합물의 1:10의 비율로 조합한 경우에서 피부장벽 강화의 효과를 제공할 수 있다고 사료된다.
7) 미네랄 복합물을 포함한 알로에 베라 부정근의 조직배양 피토 DNA 복합물의 섬유아 세포에서 MMP-1 생성 억제 효과 측정
피부탄력을 결정하는 콜라겐과 엘라스틴은 elastase matrix metalloproteinases (MMPs)와 interstitial collagenases와 같은 세포외기질(extracellular matrix, ECM) 단백질을 분해하는 여러 효소에 의해 분해될 수 있다. 이러한 분해효소들의 과발현은 주름을 유발하며 피부탄력감소의 주요한 원인이다(Kim et al., 2020b). 특히나 MMP-1은 인체에서 콜라겐에 특이적으로 작용하는 단백질 분해 효소이므로(Nagase & Woessner, 1999) 과발현한다면 피부결합조직구성의 분해를 유도한다. 이들의 발현을 저해할 수 있다면 피부 노화와 탄력 감소를 늦출 수 있다(Pittayapruek et al., 2016). 따라서 본 연구에서는 피토 DNA의 MMP-1 발현억제능을 확인하고자 하였다.
다양한 비율로 혼합된 복합물의 MMP1 발현율을 Figure 3의 (d)에 나타내었다. 미네랄 혼합물과 다양한 비율로 혼합한 Sample 2-1~4의 경우에 미네랄 복합물의 비율이 증가함에 따라 MMP1의 발현이 감소하는 경향을 보이며 Sample 2-4에서 가장 낮은 발현율을 보여주었다. 피토 DNA 복합물 또는 미네랄 복합물만을 처리한 경우인 Control 2-1, 2의 MMP1의 발현율은 청색광을 노출시킨 경우와 비교하여 약하게 감소된 발현율을 보였다. 이 수치는 Sample2-4의 경우보다 상당히 높으므로 피토 DNA 복합물 또는 미네랄 복합물의 단일 제제가 아닌 복합물의 1:10 비율의 조성일 때 우수한 MMP1 발현 억제능이 있음을 확인하였다. 유사한 연어의 이리에서 분리한 PDRN의 경우에서도 MMP1의 감소를 확인할 수 있었으므로(Kim et al., 2020b) 유사한 기작을 가질 것으로 사료된다. 따라서 피부탄력에 효능을 가지는 원료로의 가능성을 제시할 수 있었다.
8)미네랄 복합물을 포함한 알로에 베라 부정근의 조직배양 피토 DNA 복합물의 섬유아 세포에서의 COLA1A1 발현 유도능
사람의 섬유아세포에서 알로에 베라 부정근의 조직배양 피토 DNA 복합물 시료에 미네랄 복합물을 함께 포함하는 Sample 2-1~4가 콜라겐 유전자인 COLA1A1의 발현을 유도할 수 있는지 알아보기 위해 RT-PCR을 이용하여 발현량을 측정하였다. 대조군으로는 아데노신(adenosine) 50 ppm을 사용하였다. Figure 3의 (e)에 나타낸 바와 같이, 알로에 베라 부정근의 조직배양 피토 DNA 복합물 시료에 미네랄 복합물을 함께 포함하는 Sample 2-1~4의 복합물에서 미네랄 복합물의 비율이 증가함에 따라 발현량이 증가하였다. 특히, Sample 2-4의 미네랄 복합물과 피토 DNA 복합물의 비율이 10:1인 경우에서 대조군 아데노신의 경우보다도 높은 COLA1A1의 발현을 확인했다. 또한 Sample 2-1~4의 복합물에서 피토 DNA복합물 또는 미네랄 복합물을 단독으로 처리한 Control 2-1 및 2에 비하여 우수한 COLA1A1 발현을 보여주었다. 피토 DNA 복합물만 존재하는 Control 2-2의 경우, Sample 2-1인 미네랄 복합물과 피토 DNA의 비율이 1:1인 경우와 비슷한 수치의 발현량을 보였다. 미네랄 복합물만 존재하는 Control 2-2의 경우 청색광을 조사한 이후 아무런 처리를 시도하지 않은 경우와 발현량의 차이를 보여주지 않아 COLA1A1 발현을 유도하는 효과는 없다고 보았다. 미네랄복합물의 비율이 증가할수록 발현이 유도되나 단독으로서는 COLA1A1 발현유도의 효능이 없는 것으로 보아 Sample 2-4의 높은 발현 유도 효과가 미네랄 복합물만의 효과가 아닌 피토 DNA와의 특정한 비율 조성이 COLA1A1 발현을 우수하게 유도하는 것으로 사료된다. 따라서 피토 DNA와 미네랄 복합물이 1:10 비율의 조성일 때 우수한 피부탄력증가의 효능의 가능성을 제시할 수 있었다.
미네랄 복합물에 포함되어 있는 아연의 경우 피부각질세포에 존재하는 zinc metalloenzymes와 같은 효소들의 활성을 도와 상처치유에 도움을 준다(Landown et al., 2007). 또 칼슘의 경우 상처가 발생하면 해당부위의 칼슘농도가 증가하여 세포내 전사활동을 촉진하는 것이 알려져 있다(Rodrigues et al., 2019). 마그네슘의 경우 상처부 위에서 혈관신생과 염증반응을 조절하며 치유를 돕는다(Shen et al., 2019; Yin et al., 2021). 나트륨은 인체에서 중요한 미네랄 중 하나이지만 인체는 나트륨 균형에 매우 민감하게 반응한다(Titze et al., 2014). 미네랄 단일물질의 피부보호 효과보다 미네랄 복합물질의 효능이 더 높아 복합물의 상승효과가 지속적으로 연구되고 있으므로(Kim, 2005; Wei et al., 2017) 앞서 진행한 알로에 베라 부정근의 조직배양 피토 DNA 복합물과 미네랄 복합물의 SOD1, FLG, LOR, COL1A1의 발현을 증가시키는 피부장벽강화 효과는 특정한 비율에서 더 높은 효능을 보여주는 것으로 사료된다.
9)미네랄 복합물을 포함한 알로에 베라 부정근의 조직배양 피토 DNA 복합물의 피부 세포 재생 효과
HaCaT 세포에 wound healing assay를 실행하여 알로에 베라 부정근의 조직배양 피토 DNA 복합물과 미네랄 복합물의 피부세포재생효과를 확인하고자 하였다. Table 6에서 확인되는 바와 같이, 피토 DNA만 존재하는 Control 2-1의 경우에서 가장 높은 재생율을 보였고 Sample 2-1~4에서는 미네랄 복합물의 비율이 증가할수록 재생율이 증가하는 것을 보였다. 가장 낮은 세포재생율을 보여준 미네랄 복합물만을 처리한 Control 2-2의 경우를 제외하고 모두 대조군인 덱사메타손의 경우보다 높은 재생율을 보여주었다. 미네랄 복합물 단독 처리인 Control 2-2에서의 낮은 세포 재생율은 피토 DNA와 미네랄 복합물의 1:1비율 이상의 조합으로 극복될 수 있는 것으로 보였다. 특히 1:10의 비율에서 우수한 세포재생율을 보였으므로 미네랄 복합물과 피토 DNA의 특정 비율은 상승작용을 일으키는 것으로 사료된다.
3. 인체 임상시험 결과 및 고찰
1)미네랄 복합물 및 알로에 베라 부정근의 조직배양 피토 DNA 복합물을 포함한 크림의 피부 보습 개선 효과 측정
알로에 베라 부정근의 조직배양 피토 DNA 복합물과 미네랄 복합물을 함께 포함하는 크림(Sample 3)과 피토 DNA 복합물과 미네랄 복합물이 포함되어 있지 않은 크림(Control 3)을 인체적용시험을 통해 보습력을 측정하였다. Control 3의 보습력이 2주만에 31%에서 35%로 증가하여 13%p 증가한 반면 피토 DNA 복합물과 미네랄 복합물이 1:10으로 조합된 Sample 3의 크림의 경우 2주만에 32%에서 44%로 36%p가 증가하여 우수한 얼굴피부의 보습효과를 보여주었다(Table 7). 따라서 알로에 베라 부정근의 조직배양 피토 DNA 복합물과 미네랄 복합물의 비율이 1:10인 복합물을 포함하는 크림제형의 보습제로서의 효과를 확인할 수 있었다.
Conclusion
알로에 베라의 부정근을 조직배양하여 피토 DNA를 추출하였고 이를 전기영동하여 크기가 약 10 Kb인 핵산인 것을 확인하였다. 추출된 피토 DNA를 양이온 중합체인 PLL과 PAMAM을 3:1로 혼합한 양이온 혼합물과 2:1로 혼합하여 복합물을 완성하였다. 이 알로에 베라 부정근의 조직배양 피토 DNA 복합물을 통해 사람의 섬유아 세포에서의 100% 세포생존농도가 0.85±0.21%로 독성이 낮은 것으로 피부자극 유발 가능성이 낮다고 사료되었다. 또한 해당 복합물을 통하여 DPPH 라디칼 소거 활성능을 확인하여 0.05% 농도의 아스코르브산과 비슷하게 알로에 베라 부정근의 조직배양 피토 DNA 복합물은 0.1% 농도에서 92.87±0.35%의 우수한 항산화 효과를 가지는 것을 확인하였다. 청색광 조사 이후 섬유아세포의 생존율을 측정한 결과 피토 복합물의 농도가 증가할수록 세포생존율이 증가했으며 농도가 100 μg/mL일 때 80.5% 세포가 생존하여 청색광으로 인해 발생한 ROS와 같은 세포내 독성을 완화하여 생존율을 높이는 것을 확인하였다. 알로에 베라 부정근의 조직배양 피토 DNA 복합물에 칼슘, 마그네슘, 칼륨, 나트륨, 아연을 포함하는 미네랄 복합물을 첨가하여 만들어진 복합물의 세포생장효과의 상승효과를 확인하고자 했다. 그 결과 48 h 만에 HaCaT 세포의 생장 주기가 청색광조사에도 불구하고 저해없이 작동했다. 이 복합물의 SOD1, FLG, LOR, COL1A1의 HaCaT 세포에서의 발현 유도를 RT-PCR을 통해서 확인한 결과, 미네랄 복합물의 비율이 증가함에 따라 발현량이 증가했다. 그러나 단일의 미네랄복합물 혹은 피토 DNA 복합물의 발현량보다 미네랄 복합물과 피토 DNA 복합물의 10:1 비율에서 우수한 발현을 보이는 것으로 특정한 비율에서 상승효과가 있는 것으로 사료된다. MMP1의 발현량을 비교한 결과 피토 DNA 복합물 또는 미네랄 복합물의 단일의 경우보다 피토 DNA 복합물과 미네랄 복합물을 조합한 경우에서 낮은 발현을 보였고, 조합한 경우에서 미네랄 복합물의 비율이 증가할수록 낮은 발현을 보여 피부노화를 유도하는 MMP1의 발현을 억제하는 효과를 확인하였다. 마찬가지로 미네랄 복합물과 피토 DNA 복합물의 10:1 비율에서 가장 억제된 발현을 보여주어 특정 비율이 효과에 시너지를 보이는 것으로 사료되었다. HaCaT 세포에서 피토 DNA 복합물이 높은 피부재생효과를 보여주었으며 미네랄 복합물과 피토 DNA의 복합물의 다양한 비율의 조합물에서는 미네랄 복합물의 함량이 증가할수록 재생효과가 증가하는 상승효과를 확인하였다. 피부 수분 측정을 통해 피부보습효과를 확인할 결과 수분 증가량이 36%p인 것으로 대조군의 경우인 13%p 보다 우수한 보습효과를 확인하였다.
이러한 결과를 종합했을 때, 양이온 중합체를 포함하는 알로에 베라 부정근의 조직배양 피토 DNTA 복합물은 청색광으로 인한 피부의 산화 스트레스를 해소하여 노화를 방지하는 효과를 가질 수 있다. 또한 미네랄 복합물과 특정한 비율로 조성하였을 때, 피부장벽인자들의 발현을 촉진하며 보습효과를 통해 항노화 효능을 가진다는 것을 확인하였다. 특히 인체적용검사에서 확인한 바와 같이 크림제형의 기능성 원료로 사용될 수 있는 적합성을 증명하였다. 따라서 알로에의 피토 DNA 유효성분으로 포함함으로써, 우수한 피부재생, 피부장벽 강화, 보습 및 주름방지와 같은 항노화 효과를 나타낼 수 있고, 특히 청색광에 의한 피부노화를 방지하는 효과를 가지는 화장품 및 약학적 조성물의 가능성을 제시할 수 있었다.
Acknowledgements
본 논문은 2019년도 중소벤처기업부의 재원으로 중소기업기술개발 지원사업의 지원을 받아 수행된 연구임(과제번호: S2594138).
Notes
Author's contribution
D.M.K. designed and performed this experiment. W.J.K. wrote the manuscript. H.K.L. and Y.S.K. analyzed the data and performed this experiment. Y.M.C. designed this experiment.
Author details
Dong-Myong Kim (Chief Technical Officer), Biotechnology Research Institute, KJM Bio Ltd, 17 Saimdang-ro, Seocho-gu, Seoul 06649, Korea; Won-Jin Kim (Researcher), KAIST(Korea Advanced Institute of Science and Technology), Daehak-ro, Yuseong-gu, Daejeon 34141, Korea; Hyung-Kon Lee (Senior Researcher), Biotechnology Research Institute, KIM Bio Ltd., 17, Saimdang-ro, Seocho-gu, Seoul 06649, Korea; Yong-Seong Kwon (CEO), Biotechnology Research Institute, KIM Bio Ltd., 17, Saimdang-ro, Seocho-gu, Seoul 06649, Korea; Yeon-Mea Choi (Chairman), KimJungMoon Aloe Ltd, 15 Saimdang-ro, Seocho-gu, Seoul 06649, Korea.