혼합비율을 달리한 올리브, 포도, 무화과의 생리활성 평가
Biological Activity Evaluation of Olive, Grape, and Fig at Various Mixing Ratios
不同混合比例的橄榄、葡萄和无花果的生物活性评价
Article information
Abstract
목적
본 연구는 지중해식 식단에서 건강 식재료로 알려진 올리브, 포도, 무화과의 혼합물 4종의 품질 (항산화 활성, 효소 활성)을 평가가 하는 것이다.
방법
올리브와 포도 1:1 비율 [올리브(O) 30 g과 포도(V) 30 g], 올리브와 무화과 1:1 비율 [올리브(O) 30 g과 무화과(F) 30 g], 포도와 무화과 1:1 비율 [포도(V) 30 g과 무화과(F) 30 g], 올리브, 포도와 무화과 1:1:1 비율 [올리브(O) 20 g과 포도(V) 20 g과 무화과(F) 20 g]로 4종류의 혼합물을 만들었다. 혼합 비율을 달리한 4종의 혼합물의 항산화 활성(total polyphenol 함량, total flavonoid 함량, DPPH radical 소거능, ABTS radical 소거능)과 효소 활성 (α-glucosidase 저해 활성, ACE 저해 활성)을 측정하였다.
결과
혼합비율을 달리한 4종 혼합물의 total polyphenol 함량은 OVF (26.25±0.20 mg TAE/g)가 가장 높은 수치를 보였다. Total flavonoid 함량은 OVF (27.91±2.14 mg QE/g)에서 가장 높게 나타났다. DPPH radical 소거능은 OVF (98.72±0.38%)에서 가장 높게 나타났다. ABTS radical 소거능 측정 결과, OVF (42.88±1.19%)가 가장 높게 나타났다. α-Glucosidase 저해 활성 (79.75±0.15%)과 ACE 저해 활성(88.61±0.08%) 모두 OVF에서 가장 높게 나타났다.
결론
본 연구에서는 올리브, 포도, 무화과 혼합물 (1:1:1)의 생리활성(항산화 활성, 효소 활성)이 가장 높게 나타났으므로 대사증후군에 도움이 될 것이라 사료되고, 차후 이 비율의 혼합물을 이용한 제품개발을 기대한다.
Trans Abstract
Purpose
This study aimed to evaluate the antioxidation and enzymatic activity-related qualities of four mixtures prepared with different mixing ratios of olives (O), grapes (V), and figs (F), which are representative ingredients of the Mediterranean diet.
Methods
Following mixtures were prepared: olives–figs (OF), grapes–figs (VF), and olives–grapes–figs (OVF). For mixture preparation, the ingredients were mixed in following ratios: olives-to-grapes, olives-to-figs, and grapes-to-figs at ratios of 1:1 (30 g of each) as well as olives-to-grapes-to-figs at a ratio of 1:1:1 (20 g of each). The antioxidant (total polyphenol and flavonoid contents along with 2,2-diphenyl-1-picrylhydrazyl [DPPH] and 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) [ABTS] radical scavenging) and enzymatic (α-glucosidase inhibitory and angiotensin-converting enzyme [ACE] inhibitory) activities of the four aforementioned mixtures were measured.
Results
OV and OVF mixtures showed the highest total polyphenol (27.25±0.22 mg TAE/g) and flavonoid contents (27.9 ± 2.14 mg QE/g), respectively. DPPH radical scavenging ability was highest in OV (92.86 ± 0.17%). The highest ABTS radical scavenging activity was registered in the OVF mixture (42.88±1.19%). α-glucosidase and ACE inhibitory activity measurements were highest in the OVF mixture (79.75±0.15% and 88.61±0.08%, respectively).
Conclusion
Highest physiological activity levels (i.e., anti-oxidation and enzymatic activity) were observed in the olive, grape, and fig (1:1:1) mixture, hence, its regular consumption could improve metabolic syndrome.
Trans Abstract
目的
本研究旨在评估地中海饮食的代表性成分橄榄(O)、葡萄(V)和无花果(F)的不同混合比例制备的四种混合物的抗氧化和酶活性相关品质。
方法
制备以下混合物:橄榄-无花果(OF)、葡萄-无花果(VF)和橄榄-葡萄-无花果(OVF)。对于混合物制备,各成分按以下比例混合:橄榄与葡萄、橄榄与无花果、葡萄与无花果的比例为 1:1(各 30 克)以及橄榄、葡萄与无花果的比例为 1:1:1(每个 20 克)。 测定了四种不同配比混合物的抗氧化活性(总多酚含量、总黄酮含量、DPPH自由基清除活性、ABTS自由基清除活性)和酶活性(α-葡萄糖苷酶抑制活性、ACE抑制活性)。
结果
OVF 混合物显示出最高的总多酚 (26.25 ± 0.20 mg TAE/g) 和类黄酮含量 (27.91 ± 2.14 mg QE/g)。 DPPH自由基清除能力在OVF最高 (98.72±0.38%)。 ABTS自由基清除活性在OVF混合物中最高 (42.88±1.19%)。α-葡萄糖苷酶和ACE抑制活性测量值在OVF混合物中最高(分别为 79.75±0.15%,88.61±0.08%)。
结论
橄榄、葡萄和无花果(1:1:1)混合物的生理活性水平(即抗氧化和酶活性)最高,因此,经常食用可以改善代谢综合征。
Introduction
비만은 과도한 지방량으로 정의되는 다인성 복합 질환으로 현대인의 건강에 심각한 문제를 야기시키고 있다. 체내에 과도하게 축적된 지방은 염증성 아디포사이토카인 (adipocytokine)을 분비하여 전신 염증, 인슐린 저항성, 동맥경화증 및 대사 장애를 유발시키는 작용을 한다(Castro-Barquero et al., 2018). 최근의 연구들에 의해 복부비만이 대사증후군의 발생에 유의미한 상관관계에 있다는 사실(Rhee, 2022)이 확인되면서 대사증후군을 예방할 수 있는 식품에 대한 소비자의 관심이 증가하는 추세이다(Baik, 2011). 따라서 본 연구에서는 대사증후군 예방에 효과적인 식품을 찾아 그 효과와 품질을 검증하는 데 목적을 두겠으며, 그 가운데 지중해 식단에 주목하려 한다.
지중해식 식단에서 주로 사용되고 있는 식재료로 올리브오일, 과일, 푸른 채소, 콩과 식물, 견과류 및 어류 등이 잘 알려져 있다(Trichopoulou et al., 2003). 이 지중해식 식단을 섭취하는 지중해 지역 사람들에게 비만 발생률이 낮고, 심혈관계 질환의 원인으로 인한 사망률도 낮았다는 보고가 있다(Estruch et al., 2013). 이들은 비타민, 무기질 및 올레산, 페놀산, 라노스테롤 등의 생리활성 성분이 풍부한 식품으로 알려져 있다(Widmer et al., 2015). 올리브(Olea europea L.)의 올레산은 오메가-9 지방산으로 혈중 콜레스테롤 수치를 조절하는 작용이 있어 고혈압이나 심장질환 등의 만성질환 예방에 효과가 있다고 보고되었다(Mateos et al., 2020). 포도(Vitis vinifera L.)는 안토시아닌(anthocyanin), 스틸벤(stilbene), 플라보놀(flavonol), 페놀산(phenolic acid), 플라바놀(flavanol) 등의 다양한 폴리페놀류가 함유되어 있다(Chang et al., 2013). 또한, 포도의 과육 외에 껍질, 씨앗에서도 활성 성분들이 다양하게 함유되어 있어 항당뇨, 심장 및 간 보호 효과 등이 있는 것으로 보고되어 있다(Nassiri-Asl et al., 2016). 무화과 (Ficus carica L.)는 비타민, 칼륨, 섬유질, 칼슘, 철분이 풍부하며, 콜레스테롤을 낮추는 라노스테롤(lanosterol)과 스티그마스테롤(stigmasterol) 등을 함유하고 있다(Ingrassia et al., 2021).
따라서 본 연구에서는 지중해식 식단의 식재료 가운데 올리브, 포도, 무화과를 주목하여, 혼합비율을 달리 한 4종의 혼합물(올리브와 포도 1:1 비율, 올리브와 무화과 1:1 비율, 포도와 무화과 1:1 비율, 올리브, 포도와 무화과 1:1:1 비율)을 만들어 그 품질을 평가(항산화 활성, 효소 활성)하였다.
Materials & Methods
1. 실험재료
본 연구에서 올리브(Olea europea L.)는 G마켓(Dongsuh, Korea), 적포도(Vitis vinifera L.)는 이마트(Namyangju, Korea), 무화과(Ficus carica L.)는 식탐정(Sigtamjeong, Korea)에서 각각 2021년 7월에 구입하여 시료로 사용하였다.
2. 실험방법
1) 올리브, 포도, 무화과 혼합물 제조
올리브와 포도 1:1 비율[올리브(O) 30 g과 포도(V) 30 g], 올리브와 무화과 1:1 비율[올리브(O) 30 g과 무화과(F) 30 g], 포도와 무화과 1:1 비율[포도(V) 30 g과 무화과(F) 30 g], 올리브, 포도 및 무화과 1:1:1 비율[올리브(O) 20 g과 포도(V) 20 g과 무화과(F) 20 g]와 같이 4종류의 혼합물을 만들었다(Figure 1).
2) 추출물 제조
혼합 비율을 달리한 올리브, 포도, 무화과의 혼합물 4종[올리브와 포도 1:1 비율(각 30 g), 올리브와 무화과 1:1 비율(각 30 g), 포도와 무화과 1:1 비율(각 30 g), 올리브, 포도와 무화과 1:1:1 비율(각 20 g)]의 추출물은 70% EtOH에서 72 h 동안 암소에서 추출하였으며, 추출한 각각의 시료들은 다시 세 차례의 반복적인 여과(No. 3, Whatman, Maidstone, England)를 통하여 추출물을 얻었다. 얻어진 추출물은 진공감압농축기(vacuum rotary evaporator, N-1110; EYELA, Japan)를 이용해서 추출 용매(70% EtOH)를 제거하기 위해 30% 이하로 농축하였다. 농축한 추출물들은 냉동원심분리기(FD5808; Ilshin bio base Co., Ltd., Korea)로 분말화한 후 -70℃의 Ultra-low temperature freezer (WUF-500; Daihan scientific Co., Ltd., Korea)에 보관하며 실험에 사용하였다.
3) Total polyphenol 함량
혼합 비율을 달리한 올리브, 포도, 무화과의 혼합물 4종(OV, OF, VF, OVF)의 total polyphenol 함량은 Folin-Ciocalte 시약을 사용하는 방법을 참고하여 측정하였다(Singleton & Rossi, 1965). 700 μL의 시료에 140 μL의 F-C 를 가한 상태로 3 min간 정치하고, 700 μL의 2% (w/v) Na2CO3 용액을 첨가, 1 h동안 반응 과정을 거친 후에 ELISA microplate reader (Tecan Infinite M200 Pro; GreenMate Bio, Korea)를 이용하여 750 nm 구간에서 흡광도를 계측하였다. Total polyphenol 함량은 tannic acid (Sigma-Aldrish)를 이용한 표준곡선(standard curve)으로부터 환산하였다.
4) Total flavonoid 함량
혼합 비율을 달리한 올리브, 포도, 무화과의 혼합물 4종(OV, OF, VF, OVF)가 함유한 total flavonoid 함량은 다음과 같은 방식을 통하여 측정하였다. 70 μL의 시료에 700 μL의 diethylene glycol를 첨가하였고, 다시 1N-NaOH 용액 7 μL를 첨가해서 1 h동안 37℃ (Dry oven)에서 반응시킨 후 ELISA microplate reader (Tecan Infinite M200 Pro; GreenMate Bio)로 흡광도를 420 nm 구간에서 계측하였다. Total flavonoid 함량은 식물성 flavonol인 quercetin을 활용하여 작성한 표준곡선으로부터 얻었다(Davis, 1947).
5) DPPH radical 소거능
혼합 비율을 달리한 올리브, 포도, 무화과의 혼합물 4종(OV, OF, VF, OVF)의 DPPH radical 소거능은 다음과 같은 방법으로 실시하였다(Blois, 1958). 시료 100 μL에 100 μL의 1.5×10-4 M DPPH 용액을 가하고 30 min간 암실에 방치한 후(실온) ELISA microplate reader (Tecan Infinite M200 Pro; GreenMate Bio)로 흡광도를 517 nm 구간에서 계측하였다.
6) ABTS radical 소거능
혼합 비율을 달리한 올리브, 포도, 무화과의 혼합물 4종(OV, OF, VF, OVF)의 ABTS radical 소거능은 다음과 같은 방법으로 계측하였다(Fellegrini et al., 1999). 같은 비율의 ABTS 7.4 mM과 potassium persulfate 2.6 mM을 혼합한 후 하루 동안 암실에 방치하여 ABTS 양이온 형성 과정을 거친 후, 1×PBS로 희석하여 732 nm 구간에서의 흡광도 값을 0.70±0.03이 되도록 조정하였다. 이후 희석된 ABTS + 용액 190 μL에 시료 10 μL를 가하여 10 min간 정치하고 ELISA microplate reader (Tecan Infinite M200 Pro; GreenMate Bio)로 흡광도를 732 nm 구간에서 계측하였다.
7) α-Glucosidase 저해 활성
혼합 비율을 달리한 올리브, 포도, 무화과의 혼합물 4종(OV, OF, VF, OVF)의 α-glucosidase 저해 활성은 다음과 같은 방법을 참고하여 계측하였다(Li et al., 2005). 우선 67 mM phosphate buffer와 시료 100 μL에 1 unit/mL 농도로 용해한 α -glucosidase 200 μL을 넣었다. 다시 대조군(control)에는 67 mM phosphate buffer 100 μL를 넣어 37℃에서 15 min간 반응시켜 sample 시료를 대체하기로 하였다. 5 mM 4-Nitrophenyl α -D-glucopyranoside (pNPG)은 기질로 사용하였는데, 이는 67 mM phosphate buffer에 용해하여 100 μL를 넣은 후 15 min간 37℃에서 반응시킨 후 ELISA microplate reader (Infinite M200 pro; M ä nnedorf Switzerland)로 흡광도를 405 nm 구간에서 계측하여 저해율을 산출하였다.
8) ACE 저해 활성
혼합 비율을 달리한 올리브, 포도, 무화과의 혼합물 4종(OV, OF, VF, OVF)의 ACE (angiotensin-converting-enzyme) 저해 활성은 다음과 같은 방법을 참고하여 계측하였다(Cushman & Cheung, 1971). 50 mM HCl buffer (sodium chloride를 300 mM 함유, pH 8.3)로 HHL (Hippury-L-Histidyl-L-Leucine) (5 mM)에 용해시켜서 기질 용액을 제조한다. ACE 용액은 효소로 사용되는데, 기질 제조 시 이용한 것과 같은 HCl buffer (pH 8.3)에 10% lung acetone powder rabbit을 4℃에서 overnight 한 후, 원심분리(12,000 rpm, 30 min, 4℃)하여 상층 액을 이용하였다. ACE 저해 활성은 ACE 효소 50 μL, HHL 150 μL와 sample 시료 50 μL를 혼합하여 분석하였으며, 대조군(control)은 sample 시료 대신 증류수 50 μL를 첨가한 것 외에 다른 조건은 동일하게 유지하여 37℃에서 30 min간 반응시켰다. 이후 1 M HCl 250 μL를 첨가하고 반응 과정을 정지시킨 후, 다시 ethylacetate 500 μL를 첨가하고 15 s 간 교반한 다음 3000 rpm으로 5 min간 원심분리 시켜 상등액 200 μL를 취하였다. 이것이 완전히 건조해질 때까지 120℃에서 30 min간 노출시켰다. 건조물에 증류수 1 mL를 가하여 용해시키고 228 nm 구간에서 흡광도를 계측하여 ACE 저해율을 산출하였다.
9) 통계처리
실험 자료들의 분석 및 통계처리는 통계 분석 소프트웨어(SPSS statistics 27; SPSS Inc., USA)로 평균과 표준편차를 구하였다. 독립변수의 요인이 3개 이상이 확인되면 one-way ANOVA를 실시한 후, Duncan's multiple range test로 유의수준(p<0.05)에서 사후 검정을 하였다.
Results & Discussion
1. 올리브, 포도, 무화과 혼합물의 항산화 활성 측정
1) Total polyphenol 함량
식물성 식품 속에 함유된 폴리페놀은 생리활성물질로 높은 항산화 활성을 가진 천연 항산화제로 알려져 있다(Shahidi & Ambigaipalan, 2015; Graf et al., 2005).
본 연구에서는 올리브(O), 포도(V) 및 무화과(F)의 혼합비율을 달리한 4종의 혼합물을 에탄올로 추출하고 total polyphenol 함량을 분석하여 Table 1에 제시하였다.
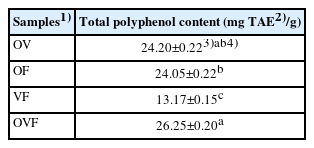
Total polyphenol content of the four mixtures prepared with olives, grapes, and figs at different mixing ratios
올리브, 포도 및 무화과 혼합물(OVF, 26.25±0.20 mg TAE/g)이 가장 높았고, 그 다음은 올리브와 포도 혼합물(OV, 24.20±0.22 mg TAE/g), 올리브와 무화과 혼합물(OF, 24.05±0.22 mg TAE/g), 포도와 무화과 혼합물(VF, 13.17±0.15 mg TAE/g)의 순이었다.
2) Total flavonoid 함량
식물에 존재하는 다양한 이차 대사산물 가운데 페놀성 화합물은 건강에 유익한 작용을 하는 것으로 알려져 있다(Hanasaki et al., 1994). 식이성 페놀 화합물에 포함되는 페놀산, 플라보노이드, 스틸벤, 고분자 프로안토시아니딘(polymeric proanthocyanidin) 등은 천연 항산화 물질로(Shahidi & Peng, 2018), 이중 플라보노이드는 Cu, Fe 이온과 안정적 금속이온복합체를 형성하고, 직접 항산화 효소 활성을 증가시켜서 자유 라디컬을 직접 소거하는 방식으로 세포막과 세포 내 물질을 보호한다고 알려져 있다(Husain et al., 1987).
본 연구에서는 올리브(O), 포도(V) 및 무화과(F)의 혼합비율을 달리한 4종의 혼합물을 에탄올로 추출하고 total flavonoid 함량을 분석하여 Table 2에 제시하였다.

Total flavonoid content of the four mixtures prepared with olives, grapes, and figs at different mixing ratios
OVF의 total flavonoid 함량(27.91±2.14 mg QE/g)이 가장 높았고, OV (26.57±1.19 mg QE/g), VF (12.27±1.68 mg QE/g), OF (11.93±0.32 mg QE/g)의 순으로 결과가 나왔다. Yang et al. (2020)의 올리브 추출물의 total flavonoid 함량 0.055 mg QE/g, Zeghad et al. (2019)의 포도 추출물의 total flavonoid 함량 14.37±0.04 mg QE/g, Meziant et al. (2022)의 무화과 추출물의 total flavonoid 함량 0.505 mg QE/g과 비교 시 본 연구의 올리브, 포도 및 무화과 혼합물 (OVF)의 total flavonoid 함량(27.91±2.14 mg QE/g)이 높게 나타났다. 이는 단일 과일(올리브, 포도, 무화과)에 비해 3가지 과일이 혼합되었을 때 시너지 효과가 나타난 것으로 사료된다.
3) DPPH radical 소거능
DPPH는 1,1-diphenyl-2-picrylhydrazyl의 유기적 화합물이며 산화된 형태에서 자유 라디컬을 가지고 있어 항산화제와 만나면 전자를 얻어 보라색에서 노란색으로 변화하면서 환원된다(Brand-Williams et al., 1995). 라디컬 소거작용은 인체의 질병과 노화를 방지하는 중요한 역할을 하며 항산화 효과나 인체에서 노화를 억제하는 척도로 이용한다(Kim et al., 2001). DPPH는 보라색을 띠게 되는 데 비 라디컬로 전환되는 과정에서 노란색으로 탈색이 되는 특징이 있고, 이러한 방법은 천연 항산화 활성을 위한 측정에 많이 이용된다(Lee et al., 2007).
본 연구에서는 올리브(O), 포도(V) 및 무화과(F)의 혼합비율을 달리한 4종의 혼합물을 에탄올로 추출하고 DPPH radical 소거능을 분석하여 Table 3에 제시하였다.
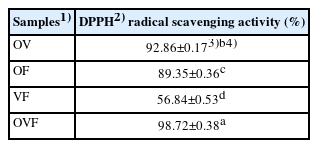
DPPH radical scavenging activity of the four mixtures prepared with olives, grapes, and figs at different mixing ratios
OVF의 DPPH radical 소거능(98.72±0.38%)이 가장 높았고, 그 다음 OV (92.86±0.17%), OF (89.35±0.36%), VF (56.84±0.53%)의 순이었다. Kim et al. (2009)의 올리브 추출물의 DPPH radical 소거능이 57.9%, Shin et al. (2023)의 농도를 달리한 5종 포도 추출물의 DPPH radical 소거능이 약 21-86%, Amessis-Ouchemoukh et al. (2017)의 무화과 추출물의 DPPH radical 소거능 20.54±0.30%와 비교 시 본 연구의 올리브, 포도 및 무화과 혼합물의 DPPH radical 소거능(98.72±0.38%)이 높게 나타났다. 이는 단일 과일(올리브, 포도, 무화과)에 비해 3가지 과일이 혼합되었을 때 시너지 효과가 나타난 것으로 사료된다.
4) ABTS radical 소거능
ABTS radical 소거능은 항산화 물질과 반응하여 라디컬 특유의 청록색이 탈색되어 추출물의 항산화 능력을 추정할 수 있다(Fellegrini et al., 1999). ABTS radical 소거능의 측정방법은 DPPH assay와 마찬가지로 인위적으로 radical을 제거하는 작용으로 DPPH radical 소거능과 유의한 상관성을 보이는 것으로 알려져 있다(Lee et al., 2011; Park et al., 2014).
본 연구에서는 올리브(O), 포도(V) 및 무화과(F)의 혼합비율을 달리한 4종의 혼합물을 에탄올로 추출하고 ABTS radical 소거능을 분석하여 Table 4에 제시하였다.

ABTS radical scavenging activity of the four mixtures prepared with olives, grapes, and figs at different mixing ratios
OVF의 ABTS radical 소거능(42.88±1.19%)이 가장 높았다. 그 다음으로 OV (35.51±1.62%)가 높게 나타났으며, 나머지 OF (29.59±0.48%), VF (24.32±0.22%) 순으로 나타났다. Ku & Lee (2018)의 올리브 추출물의 ABTS radical 소거능이 12.49±0.53%, Jeong & Youn (2016)의 포도 추출물의 ABTS radical 소거능이 42.29±2.78%와 비교 시 본 연구의 올리브, 포도 및 무화과 혼합물의 ABTS radical 소거능(42.88±1.19%)이 높게 나타났다. 이는 단일 과일(올리브, 포도)에 비해 3가지 과일이 혼합되었을 때 시너지 효과가 나타난 것으로 사료된다.
2. 올리브, 포도, 무화과 혼합물의 효소 활성 측정
1) α-Glucosidase 활성 저해 효과
α-Glucosidase는 탄수화물의 소화 과정에서 α-amylase에 의해 분해된 당질을 단당류로 전환하는데, α-glucosidase 억제제는 당질의 가수분해와 흡수를 방해하여 식사 후 혈당이 급격히 올라가는 것을 지연시킨다(Hyun & Han, 2014). 하지만 최근에는 α-glucosidase의 부작용의 사례로 인해 천연 물질에서 안전하고 효과적인 α-glucosidase 억제 물질을 발견하기 위한 여러 연구들이 진행되고 있다(Chen et al., 2009).
본 연구에서는 올리브(O), 포도(V), 무화과(F)의 혼합비율을 달리한 4종의 혼합물을 에탄올로 추출을 한 후에 α-glucosidase 저해 활성을 측정하고 Table 5에 제시하였다.
OVF (79.75±0.15%)의 α-glucosidase 저해 활성이 가장 높았고, 그 다음 VF (38.63±1.28%), OF (25.67±1.66%), OV (9.80±1.07%)의 순으로 나타났다. Mwakalukwa et al. (2020)의 올리브 추출물의 α-glucosidase 저해 활성은 약 39.4%, Sun et al. (2016)의 연구에서 포도 추출물의 α -glucosidase 저해 활성은 약 49%, Mopuri et al. (2018)의 무화과 추출물의 α-glucosidase 저해 활성은 약 33%와 비교 시 본 연구의 올리브, 포도 및 무화과 혼합물의 α-glucosidase 저해 활성(79.75±0.15%)이 높게 나타났다. 이는 단일 과일(올리브, 포도, 무화과)에 비해 3가지 과일이 혼합되었을 때 시너지 효과가 나타난 것으로 사료된다.
2) ACE 활성 저해 효과
Angiotensin converting enzyme (ACE)는 angiotensin I의 C-말단 di-peptide를 절단하여 angiotensin II를 생성하는데 이것은 고혈압을 유발하기 때문에 혈관 벽이 얇아져 터지게 되거나, 뇌졸중 등의 여러 질환이 발생한다(Lee et al., 2014).
본 연구에서는 올리브(O), 포도(V), 무화과(F)의 혼합비율을 달리한 4종의 혼합물을 에탄올로 추출 과정을 거친 후 ACE 활성 저해 효과를 측정하고 Table 6에 제시하였다.
OVF (88.61±0.08%)의 ACE 저해 활성이 가장 높게 나타났고, 그 다음으로 OF (74.95±9.41%)가 높은 수치를 보였다. 그리고 OV (58.65±6.76%), VF (46.67±4.66%) 순으로 나타났다. Hansen et al. (1996)의 올리브 추출물의 ACE 활성 저해 비율이 26%, Batista et al. (2023)의 포도 추출물의 ACE 활성 저해 비율이 18.8±0.0%와 비교 시 본 연구의 올리브, 포도 및 무화과 혼합물의 ACE 활성 저해 비율(88.61±0.08%)이 높게 나타났다. 이는 단일 과일(올리브, 포도)에 비해 3가지 과일이 혼합되었을 때 시너지 효과가 나타난 것으로 사료된다.
Conclusion
본 연구에서는 지중해식 식단 중 건강한 식재료로 사용되고 있는 올리브, 포도, 무화과의 혼합비율을 달리한 4종(OV, OF, VF, OVF)의 혼합물의 생리활성(항산화 활성, 효소 활성)을 평가하였다.
혼합비율을 달리한 올리브, 포도, 무화과 4종 혼합물의 total polyphenol 함량을 측정한 결과, OVF (26.25±0.20 mg TAE/g)가 가장 높은 수치를 보였다. Total flavonoid 함량 측정 결과, OVF (27.91±2.14 mg QE/g)가 가장 높게 나타났다. DPPH radical 소거능 측정 결과, OVF (98.72±0.38%)가 높게 나타났다. ABTS radical 소거능 측정 결과, OVF (42.88±1.19%)가 가장 높았다. α-glucosidase 저해 활성 측정 결과, OVF (79.75±0.15%)가 가장 높았다. ACE 활성 저해 효과 측정 결과, OVF (88.61±0.08%)가 높게 나타나는 등 모든 생리활성 평가에서 올리브, 포도 및 무화과 혼합물(1:1:1)의 생리활성(항산화 활성, 효소 활성)이 가장 높게 나타났다.
본 연구 결과, 1:1:1 비율의 올리브, 포도 및 무화과 혼합물(OVF)의 생리활성(항산화 및효소 활성)이 높게 나타나 대사증후군 예방 및 개선에 도움이 될 것이라 사료된다. 차후 본 연구의 결과를 바탕으로 올리브, 포도 및 무화과를 이용하여 대사증후군 개선용 제품이 개발되기를 기대한다.
Notes
Author's contribution
AJK, a messenger, personally conducted and accepted the research and design supervision of this paper. The first author, CHL, collected samples focusing on the study design of the messenger, and carried out all the experiments in the paper himself. The second author, SYL, was responsible for reviewing the experimental design in detail and correcting the errors directly. All authors read and approved the final manuscript.
Author details
Chan-Hwi Lee (Graduate Student), Department of Alternative Medicine, Kyonggi University, 63, Kyonggidaero-9 gil, Seodaemun-gu, Seoul 03752 Korea; So-Young Lee (Associate Professor), Department of Medium Therapy Graduate School of Alternative Medicine, Kyonggi University, 63, Kyonggidae-ro-9 gil, Seodaemungu, Seoul 03752 Korea; Ae-Jung Kim (Professor), Department of Nutrition Therapy, The Graduate School of Alternative Medicine, Kyonggi University, 63, Kyonggidae-ro-9 gil, Seodaemungu, Seoul 03752 Korea.


