Introduction
최근 사회적으로 확산되는 고령화 문제는 평균수명 연장과 사회적인 활동의 증가로 인해 전 세계적인 이슈가 되고 있으며, 국내의 경우 65세 이상 고령자 인구 비율이 37.4% 예상되며, 이는 선진국 고령자 비율 예측인 32% 보다 높은 수준으로 예상되고 있다. 고령화 문제와 밀접한 관련이 있은 노화는 모든 인간이 보편적, 필수적으로 겪는 생명현상으로 수명이 연장됨에 따라 전 세대에 걸쳐 안티에이징(anti-aging)분야에 대한 관심이 집중되고 있다. 특히, 노화 지연을 위한 고부가가치의 기능성 제품의 생산과 서비스를 제공하는 글로벌 항 노화에 대한 사업은 매년 10% 평균 성장률을 보이고 있으며, 이러한 현상은 노화복구보다 사전예방이 효과적이라는 인식 하에 젊은 세대부터 안티에이징 니즈(needs)가 급증하고 있다(Lee, 2017).
젊음과 아름다움을 추구하는 안티에이징 트렌드가 빠르게 확산되면서 미의 개념도 화려함에서 젊음으로 진화하고 있고, 안티에이징 트렌드 중 피부 노화에 대한 관심은 근본적으로 예방 및 치료하는 바이오 기술 기반 등 다양한 학문 분야를 통한 장기간의 연구가 진행되고 있으며, 자외선, 미세먼지 등 외부 물질에 대한 피부 손상을 개선하고자 하는 연구가 지속되고 있다. 이러한 피부 노화 연구의 종합적 메커니즘 조절의 관점이 전환되어 각질 제거 및 콜라겐 합성 등 일차원적 증상 완화에서 세포 수명, 대사 활동 등으로 새롭게 변화되고 있다(Lee et al., 2019).
노화관련 화장품 소재도 COVID19 환경과 유해 성분에 대한 경각심이 높아지면서 자연과 천연 유래의 화장품 소재가 소비자의 관심을 끌고 있고, 이로 인해 피부의 유효성을 지닌 천연 화장품 소재, 친환경 화장품 소재들의 수요 또한 매년 증가하고 있는 추세이다(Choi, 2012). 또한, 화장품을 포함한 K-beauty 산업의 호황 속에 새로운 기술 개발을 통한 화학 소재의 화장품 출시는 활성화되고 있지만, 기존 출시된 화학물질 소재의 화장품에 대한 부작용 등 많은 문제점들이 나타내고 있으며 화학물질을 대신할 천연물의 화장품 소재 및 제품 개발에 대한 수요가 절실하며 다양한 종류의 천연물이 화장품 소재로 적용 되기 위해서는 지속적으로 천연 소재 후보에 대한 연구가 필요한 상황이다.
참비름은 비름과(Amaranthaceae)에 속하는 한해살이풀로 인도가 원산지이며, 우리 나라, 중국, 일본, 타이완, 말레이시아 등 주로 열대와 아열대에 분포한다. 우리나라에서는 들과 밭에 자생하는 잡초로 3속 7종이 자생하며, 그 종류는 참비름(Amaranthus mangostanus L., A. mangostanus L.), 눈비름(Amaranthus deflexus L., A. deftexus L.), 털비름(Amaranthus retroflexus L., A. retroflexus L.), 청비름(Amaranthus viridis L., A., viridis L.), 가시비름(A. spinosus L.) 등과 구별되며, 주로 나물로 섭취되는 것은 참비름 어린잎은 나물로 사용된다(Oh & Lee, 2005). 비름과 식물에는 phytic acid, phytin-P, oxalate 및 tannin 등 기능성 물질이 풍부하며 Ca, Mg, Zn 및 K 등의 무기물과 glutamic acid, alanine, aspartic acid 및 leucine 등과 같은 아미노산이 풍부하여 영양학적으로 볼 때 꽤 우수한 식품에 해당된다(Fasuyi, 2007). 비름의 잎으로부터 분리된 nerolidol은 항산화 활성과 지질과산화 억제 효과(Pacifico et al., 2008), 동물체의 간 및 신장 조직에서 lactate, malate, glucose-6-phosphate dehydrogenase 및 glucose-6-phosphatase 등의 효소 활성을 증가시킨다는 연구보고도 있다(Holmberg, 1978). 특히, 항당뇨(Ashok et al., 2011; Kim et al., 2006), 고지혈증(Sangameswaran & Jayaker, 2008) 및 고콜레스테롤혈증에 대한 효과 등에 대한 보고가 많으며(Grajeta, 1999; Plate et al., 2002), 국내 연구로는 항균 활성(Oh & Lee, 2005)과 항바이러스 효과(Cho et al., 1995) 등에 대한 연구가 보고되어 있지만 화장품 소재로서의 연구는 미흡한 실정이다.
따라서 본 연구에서는 식용인 나물로만 사용되던 참비름(A. mangostanus L.)을 대상으로 화장품 소재로의 가능성을 확인하고자 항산화 활성, 미백 활성 및 주름 개선 효능을 조사하였고, 항산화 활성으로는 DPPH radical scavanging activity과 SOD-like activity를 조사하였다. 미백활성으로는 mushroom tyrosinase activity와 mouse melanoma cells을 대상으로 melanin 함량을 조사하였고, porcine pancreatic elastase activity와 human dermal fibroblast cells에서 collagen 함량을 조사하여 주름개선 효능을 검증하여 보고하고자 한다.
Methods
1. 실험 재료 및 시약
본 연구에 사용한 참비름(A. mangostanus L.)은 경남 김해에서 구입하여 사용하였고, 참비름 잎 600 g에 증류수 6 L (w/v%)를 첨가하여 분쇄한 후, 고압멸균기를 이용하여 4 h 고압 추출 후 원심분리(5,000 g×30 min)를 진행하였다. 그 후 상등액은 감압 농축기(EYELA N-1000; Tokyo, Japan)를 사용하여 농축한 후에 동결 건조하여 실험에 사용하였으며, 이 후 시료를 Amaranthus mangostanus water extracts (AMW)로 명명하였다. 다음으로 시료 참비름 600 g에 6 L (w/v%)의 에탄올을 첨가하여 원심 분리와 농축 과정을 반복하여 진행하였고, 농축된 시료는 동결 건조한 후, 각 실험의 단계별로 사용하였으며, 참비름 에탄올 추출물로 명명하여 Amaranthus mangostanus ethanol extracts (AME)로 명명하였다.
2. Anti-oxidant activity
가. DPPH radical scavenging activity
참비름 추출물의 항산화 활성을 측정하기 위하여 DPPH method를 사용하여 radical 소거 능력을 나타내었다(Sharma & Bhat, 2009; Jia et al., 2015). 그 방법은 96 well plate에 시료를 에탄올로 각 농도별로 조제한 용액에 1.5×10-4 M의 DPPH를 150 μL 가하여 10 s 진탕한 후, 37℃ 30 min 배양한 다음 microplate reader (Thermo scientific, Finland)를 이용하여 517 nm에서 흡광도를 측정하였다. Positive control로 L-ascorbic acid (Sigma-Aldrich, USA)를 사용하였다. 항산화 효과는 시료를 첨가하지 않은 대조군의 흡광도 차이를 비교하여 그래프로 나타내었다. 각 시료에 대한 DPPH radical 소거 작용을 3회 반복하여 측정하였다.
Radical scavenging activity (%)=[(Sample-Blank)/Control] Absorbance×100
나. SOD-like activity
SOD는 수소의 존재 하에 2분자의 superoxide를 과산화수소수와 정상상태의 산소로 전환시켜주는 역할을 하며, 유기 호흡을 하는 생물체에 광범위하게 존재하는 효소로 알려져 있다. AME와 AMW의 SOD 유사 활성 측정은 Marklund & Marklund (1974)를 응용한 SOD assay kit (Dojindo Molecular Technologies, Inc., USA)를 이용하여 superoxide anion radical (O2-)의 소거 활성을 측정하였다. 그 방법을 보면 각 실험의 단계별로 희석한 시료 20 μL와 WST working solution 200 μL를 첨가한 후, enzyme working solution 20 μL 첨가하여 37℃, 반응시간 20 min을 반응하여, microplate reader (Thermo scientific) 450 nm에서 흡광도를 측정하여 kit의 계산법에 따라 SOD 활성을 측정하였다.
SOD- l ike act iv ity (%)= [(Samp le-B lank)/Control] Absorbance×100
3. Whitening effects
가. Tyrosinase inhibitory activity
참비름 추출물의 미백 활성을 조사하기 위하여 mushroom tyrosinase 효소 저해 활성을 측정하였으며, 그 방법은 DOPA oxidase의 방법을 변형하여 측정하였다(Hearing & Ekel, 1976). 먼저 0.1 M phosphate buffer (pH 6.8) 200 μL에 기질로 1.5×10-4 M L-DOPA, L-tyrosine solution 20 μL에 시료 용액 20 μL의 혼합액에 mushroom tyrosinase (2500 U/mL) 20 μL를 첨가하여 37℃에서 10 min 반응시킨 다음 475 nm에서 흡광도를 측정하였다. Tyrosinase 저해 활성은 시료 용액의 첨가군과 무첨가군의 흡광도 감소율로 나타내었다. Positive control로 arbutin (Sigma-Aldrich)를 사용하였다.
Tyrosinase inhibitory activity (%)=[1-(Sample-Blank)/Control] Absorbance×100
나. Melanin 생합성
참비름 추출물의 세포내의 melanin 생합성 효과를 측정하기 위하여 B16F10 mouse melanoma cells을 대상으로 실험을 진행하였다(Hosoi et al., 1985). B16F10 mouse melanoma cells이 confluent 하게 자라게 되면 6 well plate에 5×105 cells/well 농도로 분주하여 24 h 안정화 시킨 후, 시료와 α-melanin stimulation hormone (α-MSH; Sigma-Aldrich, USA)로 melanin 생성을 유도하여, 72 h 동안 세포를 배양하였다. 세포를 수집하여 원심분리(1.000 g ×10 min, 4℃) 하여 침전한 후, homogenization buffer 1 mL에 (50 mM sodium phosphate pH 6.5, 1% Triton X-100, 2 mM phenyl methyl sulfonyl fluoride)로 용해시켰다. 여기서 얻은 pellet에 1 N NaOH에 10% dimethyl sulfoxide (DMSO, Merk & Co. Inc., Germany) 200 μL를 첨가하고 vortex 후 405 nm에서 흡광도를 측정하였다. Melanin 생성 억제는 positive control로 arbutin (Sigma-Aldrich)을 사용하였고, negative control로는 시료를 처리하지 않고 α-MSH만 처리한 것을 사용하여 비교, 분석하였다.
4. Anti-wrinkle effects
가. Elastase inhibitory activity
피부의 주름개선 효과를 측정하기 위하여 porcine pancreatic elastase (Sigma-Aldrich) 저해 활성을 측정하였다(Bieth et al., 1974). Elastase 저해 활성은 50 mM Tris-HCl buffer (pH 8.6)에 녹인 N-succinyl-(Ala)3-p-nitroanilide (Sigma-Aldrich) 8.8 mM 농도의 기질 20 μL를 가한 후, 50 mM Tris-HCl buffer (pH 8.6)에 녹인 porcine pancreatic elastase (2,000 U/mL) 20 μL, 25℃, 15 min 반응 후, 410 nm에서 흡광도를 비교하였다. Positive control로는 ursolic acid (Sigma-Aldrich, USA) 사용하였다.
Elastase inhibitory activity (%)=[1-(Sample-Blank)/Control] Absorbance×100
나. Collagen 생합성
Collagen 생합성 효능은 type 1 pro-collagen 생합성 kit를 사용하였으며 인간 섬유아세포인 human dermal fibroblast cells인 CCD989sk cells을 대상으로 진행하였다(Park et al., 2014). 세포를 5×105 cells/well 농도로 96 well plate에 접종한 후, CO2 배양기에서 24 h 배양하였다. 각 well에 시료를 처리한 후, 72 h 동안 배양한 배양액을 수집하여 측정에 사용하였고, 세포 배양액 내 콜라겐 생합성 정도는 type 1 pro-collagen C peptide (PIP) EIA kit (Takara Bio, Japan)을 사용하여 Kit에 포함된 표준용액으로 표준검량선을 작성하여 collagen 발현량을 산정하였다(Fan et al., 2019). Positive control로는 ursolic acid (Sigma-Aldrich)를 사용하였고, negative control로는 시료를 첨가하지 않은 무첨가군으로 비교하였다.
5. 세포독성시험
미백 실험을 진행한 B16F10 mouse melanoma cells에 대한 세포 독성과 주름개선 활성으로 측정한 인간 섬유아세포인 CCD-986sk human dermal fibroblast cells을 대상으로 세포 생존율을 조사하여 세포에 대한 독성 평가를 진행하였다(Kwak et al., 2004; Kim, 2018). Cell line은 한국세포주은행에서 분양 받아 100 U/mL Penicillin-Streptomycin과 10% fetal bovine serum (Gibco, co., USA)이 함유된 Dulbecco's Modified Eagle Media (DMEM; Gibco)에 1×105 cells/well 농도로 분주하여 24 h 배양하여 부착 및 안정화를 시켜 각 농도별로 희석한 참비름 추출물을 처리하여 24 h 배양 후, CCK-8 assay kit (Enzo, Life Science, USA)를 이용하여 450 nm에서 흡광도를 측정하였다. 시료 대신 PBS를 사용한 흡광도를 기준으로 세포의 생존율을 나타내었다.
Results and Discussion
1. 항산화 활성
참비름 추출물의 항산화 활성은 DPPH 방법과 SOD-like activity로 측정하였다. 먼저 DPPH radical 소거 활성을 보면 열수 추출물인 AMW가 에탄올 추출물인 AME보다 조금 더 높은 활성을 나타내었다(Figure 1). Positive control인 L-ascorbic acid는 1 mM의 농도에서 76%의 활성을 나타내었고, 시료의 농도가 62.5, 125, 250, 500 μg/mL일 때 열수 추출물인 AMW의 활성은 각각 30.6%, 40%, 44%, 56%으로 농도의존적으로 활성을 나타내었다. 에탄올 추출물인 AME의 활성은 농도별로 각각 6.8%, 14.6%, 15.8% 및 49%의 radical 소거 활성을 보여주었다. 항산화 활성은 다양한 생리활성의 기초분석법으로 미백, 안티에이징, 항균, 항염증 등과 연관되어 있다. 특히 DPPH 방법은 항산화 활성의 직접적인 분석법으로 결과가 비교적 쉽게 도출할 수 있는 장점을 가지고 있어서 약용이나 기능성 식물 추출물 시료의 항산화 활성 측정에 가장 일반적으로 활용되고 있다(Malherbe et al., 2014).
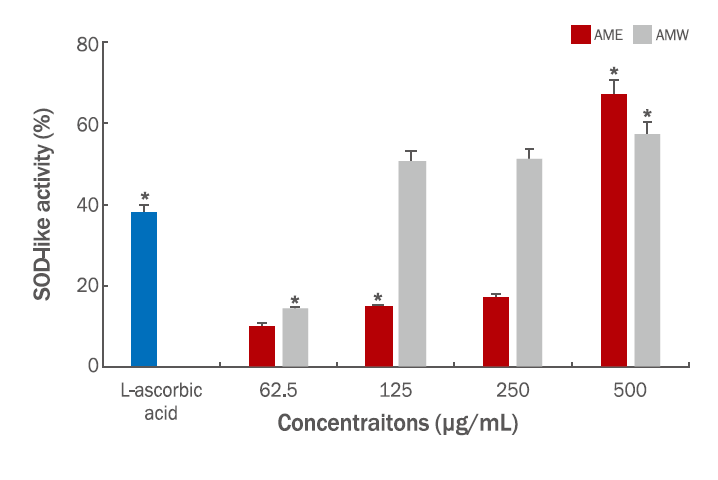
SOD는 생체 내에서 O2-(superoxide)를 제거하는 효소이며, 생체 내에 생성된 활성산소를 H2O2로 전환시키는 반응을 촉매 하는 pyrogallol의 생성양을 측정하여 SOD-like activity로 나타내었다(Lam et al., 1994). AMW와 AME의 SOD-like activity는 열수추출물인 AMW가 약 2배 정도 높게 나타났지만, 125, 250, 500 μg/mL의 농도에서 50.7%, 51%, 57%의 활성을 보여주었다. AME의 경우는 62.5 μg/mL (10.3%), 125 μg/mL (14.8%), 250 μg/mL (17.3%), 500 μg/mL (67%)으로 측정되었다(Figure 2). AME 500 μg/mL의 농도에서는 AMW보다 조금 더 높은 활성을 나타내는 것으로 판명되었고, DPPH와 더불어 SOD-like activity도 비교적 높은 활성을 지니므로 참비름 추출물의 항산화 효능을 입증하는 결과임을 확인할 수 있었고, 항산화 효능과 연계된 기전 연구를 추가적으로 할 계기가 되었다.
2. 미백 활성
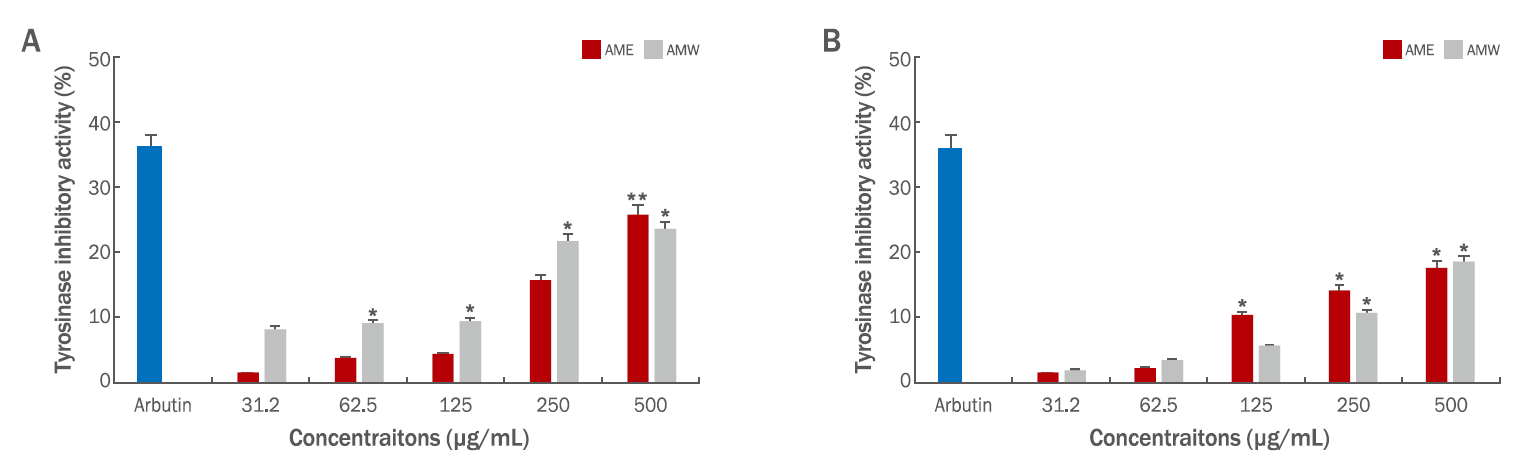
참비름 추출물의 미백 활성을 측정하기 위하여 in vitro mushroom tyrosinase 저해 활성과 B16F10 mouse melanoma cells에 대한 melanin 합성양을 측정하였다. 미백 활성의 효능을 입증할 수 있는 tyrosinase는 melanin 합성효소로서 melanosome 내에서 tyrosine을 산화시켜 DOPA를 만드는 tyrosine hydroxylase이며, DOPA를 산화시켜 DOPA quinone을 만드는 DOPA oxidase로 작용하여 melanin 중합체를 합성하는 효소로 알려져 있다(Hearing & Jiménez, 1987). AME와 AMW의 tyrosinase의 저해 활성을 2가지 기질인 L-tyrosine과 L-DOPA로 활성을 비교하였다. 먼저 L-tyrosine은 미백 원료인 arbutin 100 μg/mL의 농도로 38.6%의 저해 활성을 보여주었고 전반적으로 AMW가 AME 보다 조금 더 높은 저해 활성을 보여주었고, 시료 500 μg/mL의 농도에서 AME (25.9%), AMW (23.4%)로 높은 활성을 확인할 수 있었다(Figure 3A). L-DOPA의 기질의 결과는 시료의 농도 500 μg/mL에서 AME (17.8%), AMW (18.5%)의 활성을 나타내었고, 농도의존적으로 tyrosinase 저해 활성을 나타내었다(Figure 3B). 이러한 결과들과 관련하여 기존에 알려진 보고들에 의하면 여러 가지 식물체 내에 존재하는 페놀 화합물들은 tyrosinase의 기질인 L-tyrosine과 구조적으로 유사하여 기질 유사체의 역할을 함으로써 tyrosinase 활성을 저해하는 것으로 보고되어 있다(Sugumaran, 2002; Han et al., 2008). 참비름 추출물의 항산화 활성과 미백 활성의 관련성은 페놀성 화합물과 tyrosinase 저해 활성 사이의 높은 상관관계가 있음을 알 수 있었다 (Kim et al., 2021).
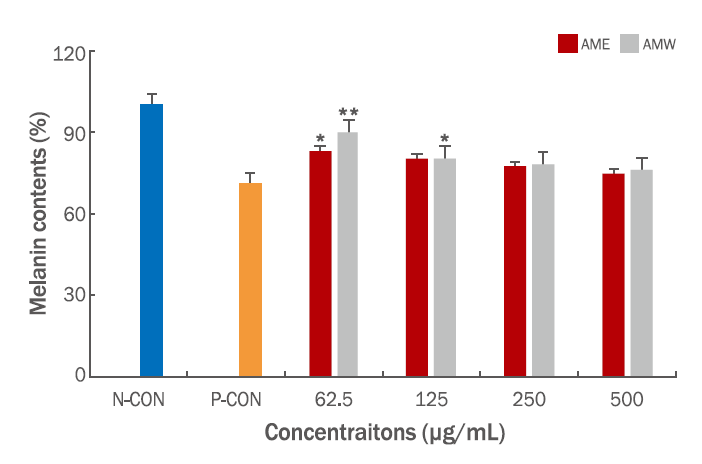
참비름 추출물을 농도별로 72 h 처리하여 B16F10 mouse melanoma cells에 대한 melanin 합성에 미치는 영향을 조사하였다(Videira et al., 2013). 실험은 생체 내 melanin 형성 자극 호르몬인 α-MSH로 melanin 형성을 유도한 후, 효과를 표준 시료인 arbutin과 비교하였으며, 그 결과는 시료의 농도 500 μg/mL의 농도에서 AME (25.5%), AMW (24.0%)의 melanin 양을 감소시키고, arbutin의 경우 29%의 melanin 감소율을 나타내었다. AME의 melanin 양을 보면 시료의 농도 62.5, 125, 250, 500 μg/mL의 농도에서 17%, 19.8%, 22.6% 및 25.5%로 감소하는 경향을 나타내었고, AMW의 경우 10%, 19.8%, 21.8%와 24.0%의 형태로 감소하였다. AME, AMW 두 추출물 모두 시료의 농도가 증가할수록 melanin 함량이 감소함을 확인할 수 있었고, tyrosinase 저해 활성과 유사한 경향으로 감소함을 알 수 있었다(Figure 4). 참비름 추출물인 AME와 AMW의 미백 활성을 확인할 수 있었고, 항산화 활성과 더불어 천연 화장품 소재로서의 높은 가능성을 확인할 수 있는 계기가 되었다.
3. 주름 개선 효과
피부 진피층을 구성하는 주요성분으로 fibronectin, hyaluronic acid, elastin, collagen 등이 있다. Elastin은 피부 건조 중량의 약 0.6%를 차지하는 경단백질로 진피의 세포와 조직 사이에 존재하는 extracellular matrix (ECM) 결합조직으로 피부의 탄력과 유연성 및 피부의 구조를 유지하는 주요 단백질이다. Elastin 구성 아미노산은 소수성 아미노산인 proline과 glycine이 많이 함유되어 있으며 기본단위는 tropoelastin이며 이 결합을 통해 elastin이 생성된다. 피부의 elastin은 진피층에 존재하며 다른 ECM 단백질들과 가교 결합을 형성하고 있기 때문에 elastin의 분해는 주름의 생성과 아주 밀접한 관계가 있다(Sephel & Davidson, 1986). Elastase는 elastin을 포함하여 collagen과 다른 ECM 단백질을 비특이적으로 분해하는 효소이며 주름을 생성하는 직접적인 원인 중 하나이다(Lee et al., 2010; Tsuji et al., 2001). 탄력과 주름에 관여하는 collagen은 피부의 형태와 강도를 유지하는 단백질이며, collagen 분해가 일어나면 피부의 탄력과 주름에 영향을 미치는 것으로 알려져 있다. Collagen 구조는 3중 나선 구조로 되어 있고, collagen은 크기와 기능, 조직 분포와 구조, 초분자 기질 등에 따라 분류되어 있다. 그 중 사람의 피부에는 I, III, IV, V, VI 및 VII 형 collagen이 분포 하고 있으며 진피층에 위치한 제 I형 collagen이 80-85%로 가장 많고, 제 III형 collagen이 10-15%, 그리고 나머지 제 IV, V, VI, VII형 콜라겐이 5% 정도를 차지하고 있다. 나이가 들면서 진피에 존재하는 collagen이 파괴되고, 이와 함께 elastin의 수와 직경이 감소하며 잘게 끊어진 것처럼 길이가 짧아진다. 이로 인해 피부의 탄력이 감소하여 피부가 늘어지고 주름이 생기게 된다(Yang & Nandi, 2015).
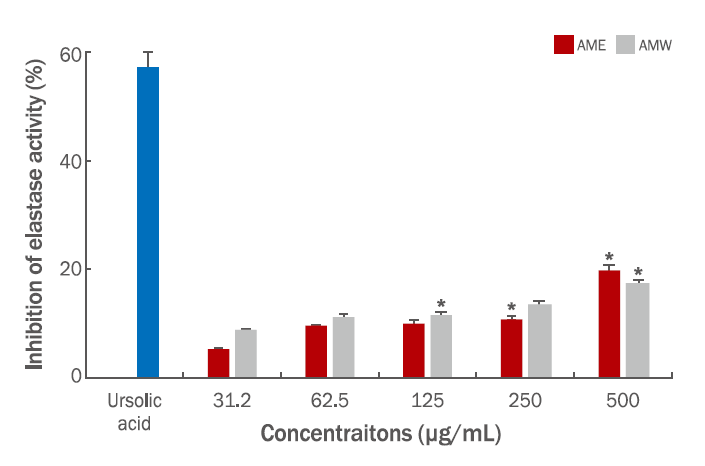
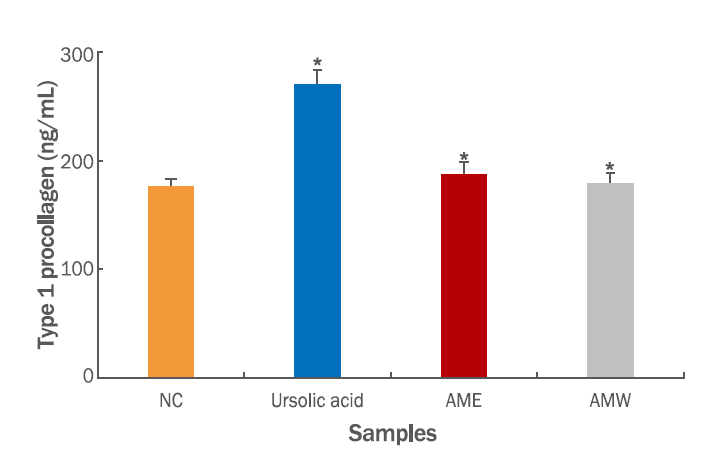
본 연구에서는 참비름 추출물의 주름개선 효능을 측정하기 위하여 porcine pancreatic elastase 저해 활성과 CCD-986sk human dermal fibroblast를 대상으로 collagen양을 조사하였다. Elastase 저해 활성의 positive control로는 elastase 저해제로 알려진 대표적인 ursolic acid를 사용하여 분석하였다. 시료의 농도는 31.2, 62.5, 125, 250 및 500 μg/mL의 농도이며 AME의 결과는 5.2%, 9.3%, 9.9%, 10.8%, 19.7%로 나타났으며, AMW의 경우, 8.6%, 11.1%, 11.3%, 13.4% 및 17.2% 저해 활성을 나타내었고, ursolic acid 100 μg/mL이 농도에서 57%의 저해 활성을 나타내었고, 시료의 저해 활성은 농도의존적으로 나타내었고, AME와 AMW 두 시료의 활성 차이는 크게 나타나지 않는 것으로 조사되었다(Figure 5). Collagen은 pro-collagen이라는 전구 물질로 합성되는데 pro-collagen은 N-말단과 C-말단의 pro-peptide들이 collagen 중합 반응에 의해 collagen으로 분리되는데 이때 pro-peptide의 양을 측정함으로써 세포내 collagen 생합성을 예측하는 지표로 사용할 수 있다(Kim et al., 2016). AME와 AMW의 type 1 pro-collagen C-peptide EIA kit를 이용하여 측정한 결과를 보면 양성 대조군으로 ursolic acid 100 μg/mL 농도와 음성 대조군으로 아무것도 처리하지 않은 null 상태의 collagen 합성양을 비교하였다. 양성 대조군의 경우 270 ng/mL으로 collagen 합성양이 확인되었고 같은 농도인 시료 AME의 경우는 188 ng/mL, AMW는 179 ng/mL으로 확인되었다. 참비름 추출물은 음성 대조군에 비하여 collagen 생합성량이 크게 영향을 미치지 못하는 것으로 나타났다(Figure 6).
4. Cell viability test
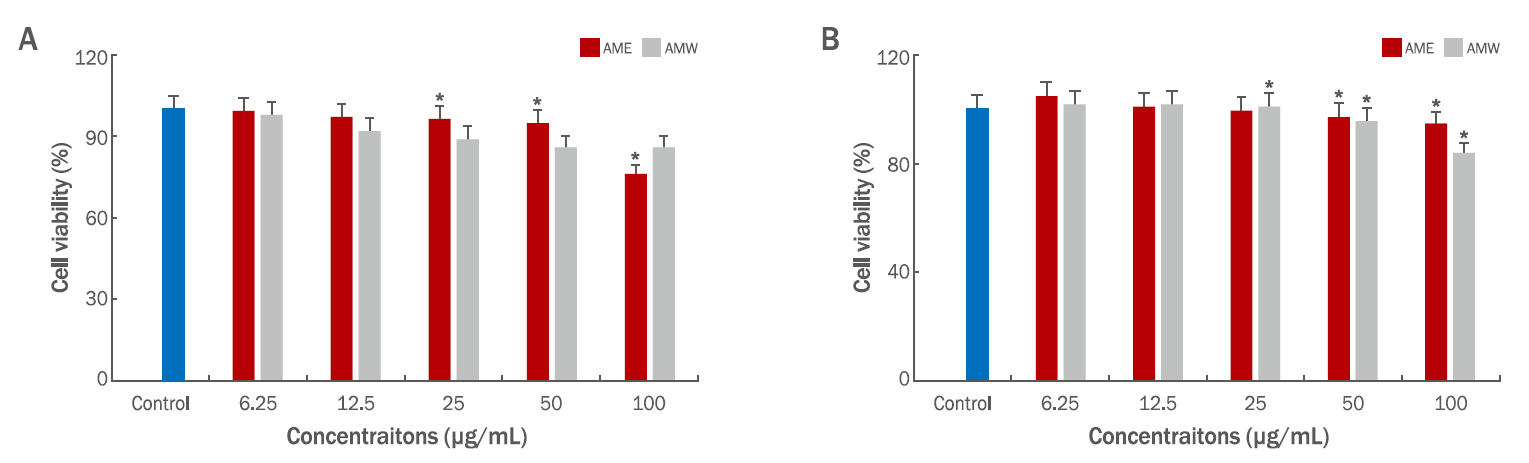
참비름 추출물의 세포독성효과를 조사하기 위하여 미백 실험에 사용한 B16F10 mouse melanoma cells과 주름개선효과에 사용한 CCD-986sk human dermal fibroblast cells을 대상으로 CCK-8 assay를 실행하였다. 먼저 melanoma cell에 대한 활성은 AME의 경우 시료의 농도 50 μg/mL에서 95%의 생존율이 확인되었고, 100 μg/mL의 농도에서는 76%의 생존율로 농도가 증가함에 따라 세포의 성장에 영향을 미치며, AMW의 경우 100 μg/mL의 농도에서 86%의 생존율을 확인할 수 있었고, 에탄올 추출물인 AME가 세포의 성장을 저해하는 것으로 나타났다(Figure 7A). 인간 섬유아세포인 CCD-986sk human dermal fibroblast에 대한 세포 생존율은 100 μg/mL의 농도에서 열수 추출물 AMW가 94.5% 이상으로 활성을 나타내었고, 반면에 에탄올 추출물인 AME의 경우 83.6%로 좀 더 영향을 미치는 것을 확인 하였다(Figure 7B).
Conclusion
본 연구에서는 식용(나물용)으로 사용되어 온 참비름(Amaranthus mangostanus)을 대상으로 열수 추출물(AMW)와 에탄올 추출물(AME)의 항산화 활성, 미백 및 주름개선 효과를 조사하여 화장품소재로서의 가능성을 확인하였다. 미백 효과로는 mushroom tyrosianase 저해 활성과 melanin 생합성, 주름 개선효과로는 porcine pancreatic elastase 저해 활성과 collagen 생합성양을 측정하였고, 두 활성에 사용된 mouse melanoma cells과 human dermal fibroblast cells을 대상으로 세포 생존율을 조사하였다.
DPPH 방법으로 조사한 항산화 활성은 시료의 농도 500 μg/mL의 농도에서 AME (49%), AMW (56%)의 radical 소거 활성을 나타내었고, SOD-like activity를 측정한 결과, 시료의 농도는 동일하게 500 μg/mL에서 AME (67%), AMW (57%)의 활성을 나타내었다. 미백활성으로는 L-tyrosine을 기질로 사용한 tyrosinase 저해 활성은 AME (25.9%), AMW (23.4%)로 나타내었고 L-DOPA의 경우 AME (17.8%), AMW (18.5%)의 높은 미백효과를 확인 할 수 있었다. B16F10 mouse melanoma cells을 대상으로 melanin양을 측정한 결과, AME (25.5%), AMW (24%)의 melanin 감소율을 나타내었다.
주름개선 효능으로는, 시료의 농도, 500 μg/mL에서 elastase 저해 활성은 AME (19.7%), AMW (17.2%)로 조사되었고, type I procollagen의 collagen 양은 미미한 것으로 나타내었다. B16F10 mouse melanoma cells에 대한 세포 독성은 시료의 농도 100 μg/mL에서 AME (76%), AMW (86%)의 세포 생존율을 보여주었고, 에탄올 추출물인 AME가 76%로 열수 추출물보다 낮은 생존율을 확인할 수 있었고, 이러한 결과는 세포생존율이 추출 용매에 의한 영향인지 혹은 세포 독성에 의한 cell population의 저하로 인해 발생하는지 심도있는 연구가 필요할 것으로 생각된다. CCD-986sk fibroblast cells에 대한 세포독성 결과는 시료의 농도 100 μg/mL에서 AME (94.5%), AMW (83.6%)의 생존율을 확인할 수 있었다. 위의 결과를 바탕으로 참비름 추출물은 항산화 및 미백 활성에 탁월한 효능을 보여주었고, 화장품 소재로서의 가능성을 확인할 수 있었다.