Introduction
최근 화장품 산업분야에서는 제품의 효과를 향상시킬 수 있으며, 불안정한 생리활성 물질을 안정화 하기위해 다양한 제형기술을 연구 개발하고 있다. 이러한 방법 중 하나인 리포좀(liposome)은 불안전한 성분을 화장품 제형에 유지되도록 안정화시켜 유효성분이 피부에 잘 흡수될 수 있도록 개발된 방법 중 하나이다(Chansiri et al., 1999; An et al., 2019; Lee & Park, 2019).
초기 리포좀은 Bangham과 Horne에 의해 처음 기술되었으며, 이 후 1980년 트리암시놀론의 국소 약물 전달 시스템(drug delivery system, DDS)으로 제안되어 항생제, 백신, 항암제, 스테로이드계 약물등을 운반하는데 많이 이용되었다(Bangham & Horne 1964; Bangham et al., 1965),
현재는 antibacterial 및 antifungal agents 로도 사용될 뿐 아니라 중요한 질병의 치료인 cancer therapy 분야에서 다양하게 적용되고 있다(Allen & Cullis, 2013; Bulbake et al., 2017; Ambati et al., 2019).
리포좀 특성은 주로 composition, surface charge, size 및 method of preparation에 따라 달라진다. 리포좀은 동일한 수의 수성 구획을 둘러싸는 하나 이상의 lipid bilayers으로 구성된 콜로이드성 소포 구조로 정의할 수 있으며(Shashi et al., 2012), 이는 리포좀이 2분자막에 폐쇠 소포체 내에 수용성 지용성 모두를 내포시킬 수 있을 뿐 아니라 크기 및 변형이 용이하다는 특징이 있다. 즉, 리포좀은 친수성의 코어에 양친매성(amphipathic)의 인지질(phospholipid)과 콜레스테롤의 이중막으로 둘러싸인 작은 인공 구형의 구조체로서 친유성과 친수성을 모두 띠고 있다(Jang et al., 2014).
리포좀은 크기나 층의 형태에 따라 단일막으로 구성된 단막리포좀(unilamellar vesicle, ULV)과 이중막이 여러 겹으로 중첩되어 있는 다막리포좀(multilamellar vessiccles, MLV)으로 구분된다. 단막리포좀은 크기에 따라 20-100 nm는 작은 단막리포좀(small unilamellar vesicles, SUV)과 100-1000 nm는 큰 단막리포좀(large unilamellar vesicles, LUV)으로 구분되며, 다막리포좀의 크기는 200-3500 nm 정도로 구분한다(Laouini et al., 2012). 리포좀의 제조 방법으로는 Bangham, 소포의 역상 증발법(reverse phase evaporation of the vesicles), 초음파법(sonication), 압출법, 균질화법, 에테르/에탄올 주입법(ether injection method), 탈수-재수화법 등이 알려져 있으며(Chauhan & GuptaRecent, 2020), Bangham은 리포좀을 제조하는 가장 전형적이고 간단한 방법이다.
현재 화장품 산업에서 가장 많이 활용되고 있는 기술인 리포좀은 크림, 로션, 세럼, 마스크팩 등을 통해 피부에 유효성분 전달 및 수분 공급, 피부 보호 등 여러 기능으로 적용되고 있다. 리포좀은 코스메슈티컬 물질의 vehicles 또는 active agent로서 사용될 수 있다. 수분 부족이나 습진으로 인해 피부 장벽이 손상된 경우 리포좀은 피부 지질 단백질 및 탄수화물과 상호 작용하여, 피부에 영양을 공급 및 피부장벽(skin barrier)을 회복시키는데 도움을 줄 수 있다. 또한 리포좀의 국소 적용은 restoring action, biodegradability, biocompatibility, extended slow release of drugs에 도움을 주기도 한다. 이는 피부의 구조가 이중층 지질막을 가지고 있다는 점에서 리포좀과 유사하여 진피층을 쉽게 통과할 수 있어 표피 및 진피층에 약물의 분포에 도움을 준다(Saroja et al., 2011; Patel et al., 2012). 이와 관련 연구로는 경피 전달을 위한 탄성리포좀의 물리적 특성연구(Han et al., 2014), 비타민 C 유효성분을 포함한 리포좀형태 연구(Joo et al., 2022), 음전하를 띤 리포좀에 캡슐화된 ascorbic acid의 피부 투과 및 유지를 위한 연구(Maione-Silva et al., 2019), 섬유아 세포에 의한 콜라겐 합성 증가에 대한 연구를 포함해 리포좀 캡슐기술 개발과 피부개선효과에 대한 다양한 연구가 최근까지 이어지고 있다(Kim et al., 2020). 그러나 화장품 유효성분을 함유한 liposome과 non liposome에 대한 비교 연구는 매우 미흡하다.
한편 제라늄(Geranium maculatum, G. maculatum)은 세계적으로 널리 보급되고 사랑받는 화훼식물 중 하나이며 주요 원산지는 남아프리카 일대이다. 제라늄은 살균, 항균 및 항진균 특성이 있어 상처를 빨리 치유하는 데 도움을 주며, 진정 효과가 있어 스트레스 수준을 낮추는데 도움을 준다. 또한 불안 증상, 폐경 후 갱년기 증상 완화, 불면증 및 정맥류(varicose veins)를 치료하는 데 도움이 되는 것으로 알려져 있다(Akdemir et al., 2001). 이미 선행연구를 통해 제라늄의 항산화, 미백, 항염 효과를 확인한 바 있으며(Choi, 2022), 본 연구에서는 제라늄추출물을 함유한 liposome과 non liposome 비교연구를 통해 기능성화장품 소재로서의 활용 가능성을 확인하고자 한다.
Methods
1. 추출물
본 연구에서는 G. maculatum을 함유한 동일한 성분비의 liposome과 non liposome으로 각각 세포실험을 진행하였다. 실험에는 100 중량부에 글리세린 5 중량%, 제라늄 추출물 1 중량%, 하이드로제네이티드레시틴 1 중량%을 포함하는 화장료 조성물을 사용하였으며, 리포좀 제조 방법으로는 bangham method (BM) 방법을 실시하였다(Strijkers et al., 2005; Kim et al., 2021).
2. 세포 독성 측정
G. maculatum을 함유한 liposome과 non liposome대한 세포독성 실험에는 B16F10 (한국세포주은행)을 사용하였으며, MTT assay를 이용하여 측정하였다. 세포 배양 배지로는 Dulbecco's Modified Eagle Medium (DMEM; GE healthcare, USA) 사용하였다. Fetal bovine serum (FBS; Sigma, USA) 5%를 첨가하여 제조한 후 항생 물질로는 Penicillin-Streptomycin (100X) (Sigma)을 사용하였다. DMSO에 희석하여 처리한 liposome과 non liposome 각각에 전 배양된 B16F10을 96 well plate에 well 당 5.0×103 cell을 주입한 후 24시간 배양하였다. 배양 끝난 후 상층액을 제거한 뒤 시료가 포함된 DMEM을 100 μg/mL를 기준으로 다양한 농도로 처리한 뒤 72시간 동안 배양하였다. 2차 배양이 끝난 후 상층액이 제거된 MTT용액 5 mg/mL 가해준 뒤 온도 37℃, CO2 농도 5%의 조건에서 3시간 동안 MTT를 결정화 시켰다. 각각의 well에 생성되어 있는 결정이 손상되지 않도록 상층액을 제거한 후 결정을 DMSO로 녹여 UV-Vis Spectrophotometer (Ultrospec 3100 pro; GE Healthcare, USA)를 이용해 540 nm 파장에서의 흡광도를 측정하였다.
3. Melanin 생성 억제 효과 측정
Melanin 생성 억제 실험을 위해 B16F10을 사용하였다. 세포의 배양에는 세포 독성 측정과 동일한 배양액을 사용하였으며, 멜라닌 생성 억제능 측정을 위해 전 배양된 B16F10을 96 well plate에 well 당 5.0×103 cell을 주입하여 24시간 배양하였다. 배양 후 상층액을 제거한 뒤 α-MSH (100 nM) 및 시료가 100 μg/mL를 기준으로 다양한 농도로 포함된 DMEM을 처리한 뒤 72시간 동안 배양하였다. 그 후 상층액을 회수하여 100 μL를 96 well plate에 옮겨 UV-Vis Spectrophotometer (Ultrospec 3100 pro; GE Healthcare, USA)를 이용해 405 nm 파장에서 흡광도를 측정하였다(Hosoi et al., 1985).
4. Tyrosinase 생성 억제 효과 측정
Tyrosinase생성 억제 효과를 확인하기 위해 B16F10을 사용하였다. 세포의 배양에는 세포 독성 측정과 동일한 배양액을 사용하였으며, 전 배양된 B16F10을 96 well plate에 well 당 5.0×103 cell을 주입하여 24시간 배양하였다. 배양이 끝난 후 상층액을 제거한 뒤 α-MSH (100 nM) 및 시료가 100 μg/mL를 기준으로 다양한 농도로 포함된 DMEM을 처리한 뒤 72시간 동안 배양하였다. 그 후 RIPA buffer를 100 μL 처리한 뒤, 해당 세포 분해액을 tyrosinase ELISA kIt (MyBioSource, Inc., USA)에 적용하여 tyrosinase 양을 측정하였다.
5. NO 생성 억제능 분석
NO 생성 억제능 분석에는 염증전달 물질 중 하나인 NO에 대한 농도를 측정하였다. NO는 반응성 질소종(reactive nitrogen species)의 하나이며, 최근 염증반응의 중요한 작용인자로 알려진 바 있다(Schmidt & Walter, 1994; Shapira et al., 1996). G. maculatum을 함유한 liposome과 non liposome대한 염증 억제능 분석에는 RAW 264.7 cell을 사용하였으며, 세포 배양 배지로는 DMEM broth를 사용하였다. G. maculatum을 함유한 liposom과 non liposome을 DMSO에 용해시켜 처리한 후 NO측정을 위해 RAW 264.7을 96 well plate에 well 당 1×104 cell을 농도로 seeding 하였다. 이 후 온도 37℃, 5% CO2 조건에서 1일간 세포를 배양하였다. 배양 후 상층액을 제거한 뒤 100 μg/mL를 기준으로 다양한 농도로 처리하였다. 이 후 lipopolysaccharide (LPS; Sigma)의 농도가 1 μg/mL가 되도록 처리하여 48시간 동안 배양하였다. 회수된 상층액을 Griess reagent 100 μL와 상층액 100 μL를 혼합하여 G. maculatum을 함유한 liposome 과 non Liposome 의 배양 상층액의 NO 농도를 측정하였다.
6. MTT assay에 의한 세포 생존율 측정
G. maculatum추출물을 함유한 liposom과 non liposome의 세포에 대한 독성 측정은 가장 널리 이용되는 방법인(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetra zolium bromide, MTT) 시약을 이용한 방법으로 분석하였다(Jew et al., 2003). 생존율 측정을 위해 RAW 264.7을 96 well plate에 well 당 1×104 cell을 다양한 농도로 24시간 동안 처리하였다. 각 well 당 20 μL의 MTT용액을 첨가한 후 온도 37℃, 5% CO2 incubator (Hanbaek, Korea)에서 4시간 동안 반응시켰다. 이 후 microplate reader (Tecan, Mönnedorf, Switzerland)를 이용하여 540 nm에서 흡광도 변화를 측정해 시료의 세포독성을 확인하였다.
Results and Discussion
1. 세포 독성 측정
Table 1은 G. maculatum을 함유한 liposome과 non liposome 의 B16F10에 대한 세포 독성을 측정한 결과이다. NADH 등이 세포 내 환원성 물질에 의해 MTT가 결정화 되는 것을 이용하여 세포의 활성 및 생존율을 측정하였으며, 배지에서의 최종 농도는 12.5-100 μg/mL 가 되도록 배합하여 배양을 진행하였다.
실험 결과 liposome은 100 μg/mL 농도에서 84.8±1.4%, 50 μg/mL 농도에서 90.1±0.9%, 25 μg/mL 농도에서 93.5±1.8%, 12.5 μg/mL 농도에서 97.5±0.8%로 나타났다. Non liposome의 경우 100 μg/mL 농도에서 90.5±1.5%, 50 μg/mL 농도에서 92.8±1.8%, 25 μg/mL 농도에서 95.3±1.1%, 12.5 μg/mL 농도에서 99.5±1.3%로 나타나 non liposome보다 liposome이 세포독성이 낮음을 확인할 수 있었다.
실험결과 식품의약품안전처 고시 제2014-115호와 ISO 10993-5의 기준에 따라 non liposome과 liposome 모두 모든 실험 농도에서 세포독성이 나타나지 않은 것으로 확인되었다.
2. B16F10에 대한 멜라닌 생성 억제 효과 측정
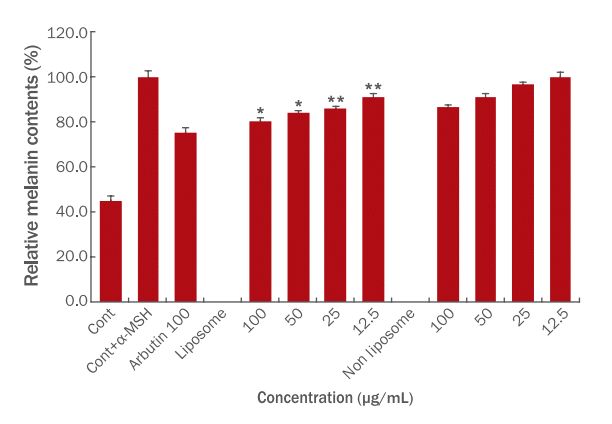
Figure 1 은 G. maculatum을 함유한 liposome과 non liposome의 B16F10에 대한 멜라닌 생성 억제 효과를 측정한 결과이며, 양성대조군인 arbutin 100 μg/mL 농도로 처리했을 때 24.4%의 저해효과를 확인 할 수 있었다. α-Melanocyte stimulating hormone (α-MSH)를 처리된 B16F10가 흑갈색의 멜라닌을 생성하는 것을 이용하여 멜라닌 생성량을 측정하였다. 자외선에 의한 α-MSH의 영향이 중요하며, α-MSH와 결합하여 cyclic adenosine monophosphate (cAMP)와 protein kinase A (PKA)를 통해 melanin 생성에 관련된 인자들을 활성화시켜 멜라닌 증식과 색소 증가에 관여하는 것으로 알려진 바 있다(Kim et al., 2011; Park et al., 2010; Park et al., 2011).
실험 결과, liposome은 100 μg/mL 농도에서 80.6±1.5%, 50 μg/mL 농도에서 84.1±1.0%, 25 μg/mL 농도에서 86.0±1.0%, 12.5 μg/mL 농도에서 91.1±1.8%로 나타났다. Non liposome의 경우 100 μg/mL 농도에서 86.4±1.3%, 50 μg/mL 농도에서 91.1±1.8%, 25 μg/mL 농도에서 96.7±1.1%, 12.5 μg/mL 농도에서 100.2±1.7%로 나타났다. 이러한 결과를 바탕으로 liposome 제형이 non liposome 제형에 비해 melanin 생성 억제에 더 효과적인 미백 개선 소재로서의 가능성을 확인하였다.
3. Tyrosinase 생성 저해 효과 측정
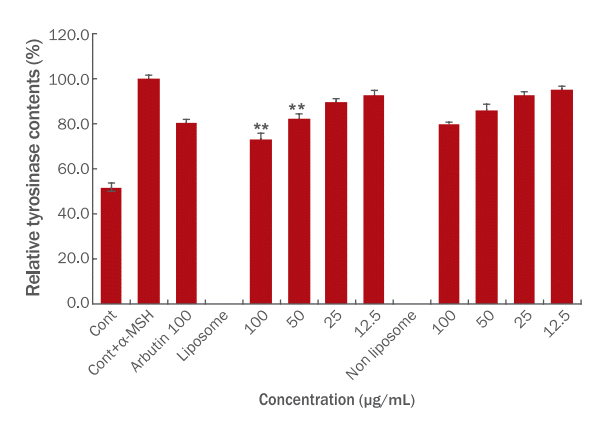
Tyrosinase 효소 활성 저해 효과 측정은 α-MSH를 처리한 B16F10가 멜라닌 생성 효소인 tyrosinase를 생성하는 것을 이용하여 측정하였다. G. maculatum을 함유한 liposome과 non liposome의 tyrosinase 측정결과는 Figure 2와 같다.
실험 결과, liposome은 100 μg/mL 농도에서 73.2±2.4%, 50 μg/mL 농도에서 82.1±2.4%, 25 μg/mL 농도에서 89.7±1.3%, 12.5 μg/mL 농도에서 92.5±2.6%로 나타났다. Non liposome의 경우 100 μg/mL 농도에서 79.9±0.8%, 50 μg/mL 농도에서 86.1±2.8%, 25 μg/mL 농도에서 92.5±1.7%, 12.5 μg/mL 농도에서 95.4±1.1%로 나타나 non liposome보다 liposome이 tyrosinase 생성 저해에 효과가 있음을 확인할 수 있었다. 또한 양성대조군인 arbutin은 100 μg/mL 농도로 처리했을 때 19.6%의 저해효과를 나타났다. Non liposome의 경우 100 μg/mL 농도에서 20.1%로 나타나 arbutin과 유사한 결과가 나타났으며, liposome의 경우 100 μg/mL 농도에서 26.8%로 나타나 arbutin에 비해 높은 미백효과가 있음을 확인할 수 있었다.
4. NO 생성 억제능 분석
G. maculatum을 함유한 liposome과 non liposome이 macrophage의 염증반응에 미치는 영향을 확인하기 위해서 griess reagent로 NO 생성량 측정한 후 염증반응의 감소율을 측정을 실시하였다. 배지에서의 최종 농도는 12.5-100 μg/mL가 되도록 배합하여 배양을 진행하였으며, Table 2는 염증과 관련된 지표인 NO의 감소율을 계산한 결과이다.
실험 결과, liposome은 100 μg/mL 농도에서 81.2±1.2%, 50 μg/mL 농도에서 88.7±0.7%, 25 μg/mL 농도에서 92.3±0.5%, 12.5 μg/mL 농도에서 95.1±2.1로 염증 억제율이 나타났다. Non liposome의 경우 100 μg/mL 농도에서 88.0±0.9%, 50 μg/mL 농도에서 94.3±0.5%, 25 μg/mL 농도에서 97.4±1.1%, 12.5 μg/mL 농도에서 100.0±0.3%로 염증 억제율이 나타나 non liposome보다 liposome이 NO 생성을 조절할 수 있는 항염증 활성을 보유한 것으로 사료된다(Table 2).
5. MTT assay에 의한 세포 생존율 측정
G. maculatum을 함유한 liposome과 non liposome의 세포 생존율 실험 결과 liposome은 100 μg/mL 농도에서 89.7±1.7%, 50 μg/mL 농도에서 92.2±0.4%, 25 μg/mL 농도에서 96.4±1.9%, 12.5 μg/mL 농도에서 99.7±1.2로 생존율이 나타났다. Non liposome의 경우 100 μg/mL 농도에서 91.7±0.6%, 50 μg/mL 농도에서 95.8±0.9%, 25 μg/mL 농도에서 98.6±1.3%, 12.5 μg/mL 농도에서 99.6±1.1%로 생성율이 나타나 non liposome보다 liposome이 높은 생존율을 나타내는 것을 확인 하였다(Table 3).
Conclusion
본 연구에서는 G. maculatum을 함유한 liposome과 non liposom을 이용하여 리포좀 제형이 화장품 원료로서 효능을 확인하기 위하여 미백, 항염 실험 및 세포독성 실험을 실시하였다.
세포 독성 실험과 항염 활성 측정결과, 모든 실험 농도 범위에서 80% 이상의 세포가 생존하여 G. maculatum을 함유한 liposome과 non liposom이 낮은 독성을 가지고 있음을 확인할 수 있었다. 또한 NO 생성에 미치는 영향을 분석한 결과 농도 의존적인 NO 생성 저해능을 확인할 수 있었다.
이러한 결과를 종합해 볼 때, G. maculatum을 함유한 non liposome보다 liposom이 기능성화장품 소재로서의 활용 가능성이 높음을 시사한다. 그러나 지금까지의 연구들이 투과율을 높여 경피 흡수율을 증가시키는 것에 집중되어왔다면, 더 나아가 liposom이 non liposome 군에 비해 높은 미백 효과와 항염효과를 나타내는 지에 대한 연구가 필요하다고 본다.